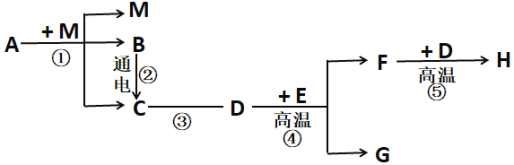
题目内容
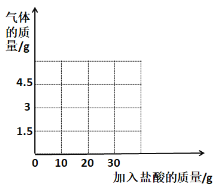
【题目】兴趣小组的同学想测定某石灰石样品中碳酸钙的质量分数,他们取9克石灰石于烧杯中并慢慢加入盐酸,测得反应过程剩余固体质量与加入盐酸的质量关系如图所示(石灰石中的杂质不与盐酸反应也不溶于水)
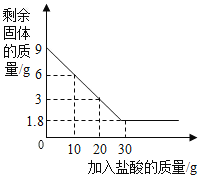
请回答下列问题:
(1)石灰石中所含杂质的质量是________,碳酸钙的质量分数是__________。
(2)通过计算求该样品完全反应生成二氧化碳的质量______(该结果精确到0.1g)。
(3)当加入_______克盐酸时,反应恰好停止。
(4)根据以上数据画出产生的气体与加入的盐酸质量的关系图_______。
【答案】1.8 80% 3.2g 24 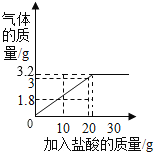
【解析】
(1)根据测得反应过程剩余固体质量与加入盐酸的质量关系图可知,杂质的质量=1.8g,碳酸钙的质量=9g-1.8g=7.2g,所用石灰石中含碳酸钙的质量分数=7.2g![]() ;
;
(2)设:生成的二氧化碳的质量为x。
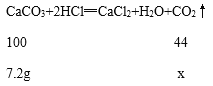
![]() x≈3.2g;
x≈3.2g;
(3)根据测得反应过程剩余固体质量与加入盐酸的质量关系图可知,消耗3g的碳酸钙对应的稀盐酸的质量为10g,进而求算7.2g碳酸钙对应的稀盐酸的质量=![]() ,即对应24g 稀盐酸时二氧化碳的质量达到3.2g;
,即对应24g 稀盐酸时二氧化碳的质量达到3.2g;
(4)根据以上数据画出产生的气体与加入的盐酸质量的关系图为: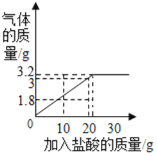 。
。

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目