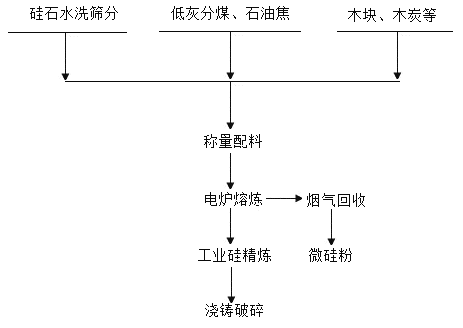
题目内容
【题目】某校实验室有一瓶久置的铁粉,已部分锈蚀,某兴趣小组对其组成进行如下探究:
(1)定性探究:
取样品平铺于白纸上,用磁铁置于样品上方,黑色固体全部被吸起,白纸上留下______色固体;将被磁铁吸起的黑色固体全部投入硫酸铜溶液中,充分反应后,过滤,所得固体全部为红色。样品中含有铁和氧化铁。
(2)定量探究:
按下图所示装置进行实验(装置气密性良好,固定装置已略去;氮气不与铁屑中的成分反应;碱石灰是氧化钙和氢氧化钠的混合物)。
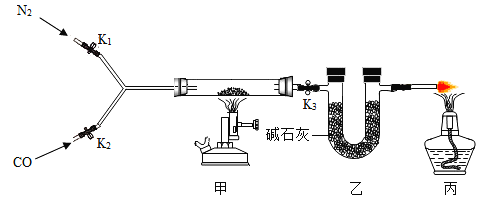
Ⅰ称量硬质玻璃管的质量。将样品放入硬质玻璃管中,称量硬质玻璃管和样品的质量。
Ⅱ连接好装置。缓缓通入N2,燃甲处的酒精喷灯,待硬质玻璃管中固体恒重,记录硬质玻璃管和剩余固体的质量。
Ⅲ再次连接好装置,继续实验。通入CO,点燃丙处的酒精灯和甲处的酒精喷灯。待硬质玻璃管中固体恒重,熄灭酒精喷灯,继续通入CO直至硬质玻璃管冷却。再次记录硬质玻璃管和剩余固体的质量。
数据如下表:
硬质玻璃管 | 硬质玻璃管和样品 | 步骤Ⅱ硬 质玻璃管和剩余固体 | 步骤Ⅲ硬质玻璃管和剩余固体 | |
质量 | m1 | m2 | m3 | m4 |
①步骤Ⅲ丙处酒精灯的作用是_______。
②步骤Ⅲ玻璃管中反应的化学方程式为______。
③样品中氧化铁的质量分数为_______(用m1、m2、m3、m4的代数式表示)。
④若步骤Ⅲ中氧化铁没有完全反应,样品中水的质量分数测量结果将_____(填“偏大”“偏小”或“不变”)。
⑤有关样品,下列说法正确的是_____(填序号,多选)。
A样品中氢元素的质量为![]()
B样品中铁单质和氧化铁的质量总和为m3-m1
C样品中铁单质的质量为m4-m1
D样品中氧元素的质量为m3-m4
【答案】红 除去尾气CO 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2 ![]() ×100% 不变 AB
×100% 不变 AB
【解析】
(1)根据实验结论,样品中有铁和氧化铁,氧化铁不能被磁铁吸引,氧化铁是红色固体,所以白纸上留下红色固体。
(2)①步骤Ⅲ中要通入CO,反应剩余的CO会污染空气,所以要用燃着的酒精灯点燃除去。
②步骤Ⅲ硬质玻璃管中是氧化铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。
③m3-m4为氧化铁中氧元素的质量,m2-m1为样品的质量。氧化铁的质量为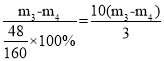 ,故氧化铁的质量分数为
,故氧化铁的质量分数为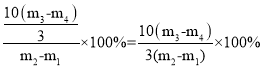 。
。
④步骤Ⅰ、Ⅱ可测定样品中水的质量分数,水的质量分数与步骤Ⅲ中氧化铁是否完全反应无关,所以步骤Ⅲ中氧化铁没有完全反应,不影响所测得的水的质量分数。
⑤A、水的质量=m2-m3,其中氢元素质量=![]() (m2-m3),故A正确;
(m2-m3),故A正确;
B、经过步骤Ⅱ样品中的水被排除,剩余固体为铁和氧化铁,硬质玻璃管和剩余固体质量为m3,硬质玻璃管质量为m1,所以剩余铁和氧化铁质量=m3-m1,故B正确;
C、反应后剩余固体为铁,来源于两部分,一个是原有的铁,一个是氧化铁还原生成,所以m4-m1中含有的铁不是样品中的单质铁,为全部铁元素的质量,故C错误;
D、样品中氧元素质量包含水和氧化铁中两部分,而m3-m4仅为氧化铁中氧元素质量,水中的质量未包括,所以D错误。