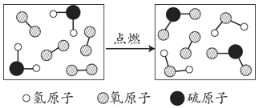
题目内容
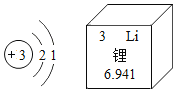
【题目】锰元素的相关信息如图所示.下列说法中正确的是
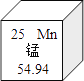
A. 属于金属元素
B. 原子核内中子数为25
C. 原子的核外电子数为30
D. 在地壳中的含量为54.94%
【答案】A
【解析】
试题A、根据元素周期表中的一格中获取的信息,该元素的名称是锰,属于金属元素,故选项说法正确.B、根据元素周期表中的一格中获取的信息,该元素的原子序数为25,而不是中子数为25,故选项说法错误.C、根据元素周期表中的一格中获取的信息,该元素的原子序数为25;根据原子序数=核电荷数=质子数=核外电子数,则该元素的原子核外电子数为25,故选项说法错误.D、根据元素周期表中的一格中获取的信息,可知元素的相对原子质量为54.94,而不是在地壳中的含量为54.94%,故选项说法错误.

 名校课堂系列答案
名校课堂系列答案【题目】某学习小组做镁在空气中燃烧实验时,发现生成物中有黑色固体,针对这一现象及该反应的应用,他们开展了如下探究,请仔细阅读并完成下列探究报告。
(探究目的)探究黑色固体是镁与空气中什么物质反应产生的。
(分析猜想)分析空气中各种成分,寻找猜想依据:
空气成分一:氧气; 空气成分二:氮气; 空气成分三:水蒸气;空气成分四:二氧化碳;空气成分五:稀有气体:化学性质很稳定,一般不与其它物质反应。
(实验一)镁带与氧气的反应
(一)制取氧气并探究氯酸钾和二氧化锰制氧气的实验中反应物与催化剂的最佳质量比。
实验中采用如图1、2所示装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中。在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200mL氧气所消耗的时间。实验记录的数据如表:
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰的质量/g | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200mL氧气时间/秒 | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
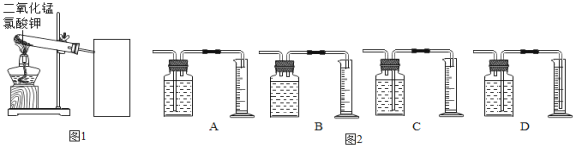
请回答下列问题:
(1)请写出该实验中发生反应的符号表达式:________;
(2)为了完成本实验,方框内应选择图2气体收集装置中的______(填字母);
(3)分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为_______;
(4)催化剂能影响化学反应速度,温度、反应物的浓度(或质量分数)、反应物接触面积等也会影响化学反应速度。分析上表数据,结合影响化学反应速度的因素分析当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是_________。
(二)燃烧镁带,观察现象将镁带打磨光亮,点燃,伸入盛满氧气的集气瓶中,产生大量白烟,生成白色固体。
实验结论:镁与氧气反应生成白色的氧化镁。写出该反应的符号表达式_______
(实验二)镁带与氮气的反应
(一)获取氮气:方法1:工业上把空气液化,然后蒸发,先蒸发出来的气体就是氮气;
方法2:实验室将氨气通过红热的氧化铜,可制得纯净的氮气和铜。属于化学变化的是____(填“方法1”或“方法2”)
(二)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛氮气的集气瓶中,瓶内壁附着一层淡黄色的固体。
实验结论:镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁,其中氮元素的化合价为-3,则氮化镁的化学式为_______
(实验三)镁带与水蒸气的反应
实验装置如下图所示:
(1)装置A中放入几粒沸石或碎瓷片的目的是__________;
(2)实验开始时,应先点燃A处酒精灯,等观察到水沸腾后,再点燃B处酒精灯,这样做的目的是_______;
(3)生成的气体通入肥皂液中,用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中,说明生成的气体是_______;
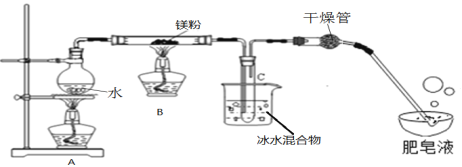
实验结论:镁粉能和水蒸气反应,但装置B中并没有产生黑色固体
(探究结论)根据以上信息,可以推理得出镁在空气中燃烧产生的黑色固体是镁与空气中的_____反应产生的。
【题目】下列图像与对应的实验相符合的是
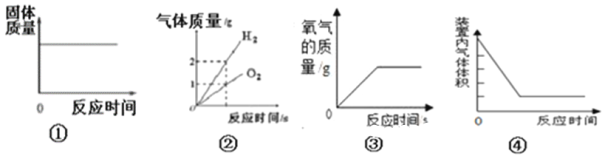
A. 图①是将一定质量的红磷放在盛有氧气的密闭容器中燃烧
B. 图②是水的电解
C. 图③是实验室用过氧化氢溶液制取氧气
D. 图④测定空气中氧气的含量时装置内气体体积
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
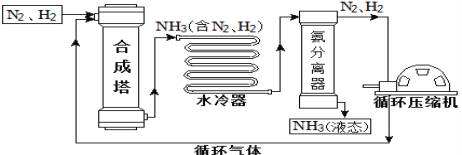
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的化学方程式是:________
(2)生产过程中可重复使用的物质是_______________(填化学式)。
(3)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105 Pa时,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在_________℃。
(4)下图是合成塔中发生反应的微观粒子示意图:
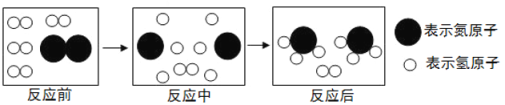
由图可知两种反应物N2与H2的分子个数比为____________;该反应中的最小粒子是_________(填写化学符号)。