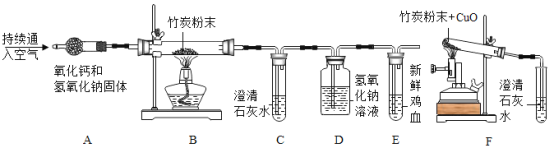
题目内容
【题目】有一包固体粉末。可能含有铜、氧化铁、氯化钠、硫酸钠、硫酸铜中的一种或几种。为了确定其成分进行如下实验,现象如图所示(部分生成物未标出,假设每步反应都恰好完全)。
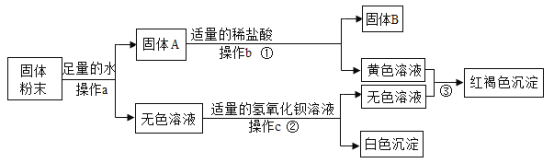
根据实验过程中的现象判断:
(1)a、b、c含同一操作,其名称是_____
(2)写出反应①、③的化学方程式_____、_____
(3)原固体粉末中一定不含有_____(填化学式)。
【答案】过滤 Fe2O3+6HCl=2FeCl3+3H2O FeCl3+3NaOH=Fe(OH)3↓+3NaCl CuSO4
【解析】
硫酸铜在溶液中显蓝色,氧化铁和盐酸反应会生成黄色的氯化铁溶液,氯化铁和碱反应会生成红褐色的氢氧化铁沉淀,硫酸根离子和钡离子反应会生成白色的硫酸钡沉淀;固体粉末中加入足量的水溶解,得到固体A和无色溶液,所以固体粉末中一定不含硫酸铜,固体A加入足量的盐酸得到固体B和黄色溶液,所以B是铜,固体粉末中含有铜、氧化铁,无色溶液加入氢氧化钡会生成白色沉淀,所以固体粉末中一定含有硫酸钠,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠。
由分析可知(1)a、b、c含同一操作,可以将不溶性固体从溶液中分离出来,其名称是过滤;
(2)反应①为氧化铁与稀盐酸反应生成氯化铁和水,化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;反应③是氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,化学方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
(3)通过推导可知,固体粉末中一定不含有的物质是CuSO4。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业。某化学兴趣小组的同学对碳酸氢钠的性质进行了如下探究。
实验一:探究碳酸氢钠溶液的酸碱性用pH试纸测得碳酸氢钠溶液的pH=10,由此可知:当向碳酸氢钠溶液中滴加紫色的石蕊试液时,溶液呈_______色。
实验二:探究碳酸氢钠的热稳定性
[查阅资料]:碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
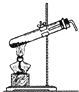
[进行实验]:为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如下图所示。

(1)加热一段时间后,观察到烧杯内壁有_______________。
(2)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是____________________________。
②为探究反应后的固体产物到底是NaOH还是Na2CO3,他们又进行了如下表的实验并得到结论,请你完成下表。
实 验 操 作 | 实验现象 | 结 论 |
_______________ | ____________ | 固体产物是Na2CO3 |