题目内容
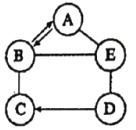
【题目】化学变化中,同种元素可在不同物质中“旅行”。(注“→”表示某种物质通过一步反应可转化为另一种物质)回答下列问题:
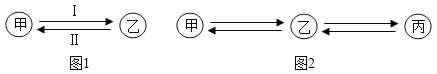
(1)按甲、乙物质所含元素种类递增的规律,完成图1所示的“旅行”。若图1为碳元素的“旅行”路线,其中甲为二氧化碳,乙为碳酸钙,写出路线Ⅱ反应的化学方程式:_____(写一个),该反应属于_____(填基本反应类型)。
(2)从单质、碱、盐中分别选择一种物质,完成图2所示的“旅行”,若甲为铜,乙为硝酸铜,则丙为_____。(填化学式)
【答案】CaCO3+2HCl═CaCl2+H2O+CO2↑ 复分解反应 Cu(OH)2
【解析】
根据已有的物质的组成、物质的性质以及物质间的转化进行分析解答即可。
(1)碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,该反应属于复分解反应,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;复分解反应
(2)丙是碱,故是氢氧化铜,故填:Cu(OH)2。

 科学实验活动册系列答案
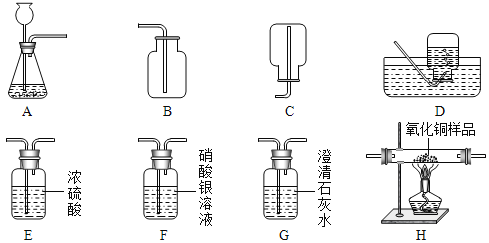
科学实验活动册系列答案【题目】实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水浑浊程度存在较大差异,于是设计实验探究影响石灰水浑浊程度的因素。
(进行实验)装置图如下所示。

实验1:取饱和澄清石灰水进行实验。
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
缓慢通入2 L空气后的浑浊程度 | 不明显 | 明显 | 非常明显 | 明显 |
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水浓度进行实验(溶液浓度变化引起的溶液密度变化忽略不计)。
实验序号 | 2-1 | 2-2 | 2-3 | 2-4 |
饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
加入蒸馏水体积/mL | 0 | a | b | c |
缓慢通入3 L空气后的浑浊程度 | 非常明显 | 明显 | 不明显 | 无现象 |
(解释与结论)
(1)小试管中发生反应的化学方程式为____________。
(2)实验1的目的为____________。
(3)实验2中a、b、c三处数据,设计合理的是________。
A 0.5 0.5 0.5 B 0.5 1.0 1.5
C 1.0 1.5 2.0 D 1.0 2.0 3.0
(4)实验2的结论是________。
(反思与评价)
(5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是________,理由是________。
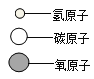
【题目】在宏观、微观和符号之间建立联系是化学学科的特点.现有A、B、C、D四种物质,其微观示意图见如表.
物 质 | A | B | C | D |
|
微观示意图 |
|
|
|
|
(1)上述物质中属于单质的是_____(填物质序号);常温下属于液体的是_____(填写化学式),日常生活中可做燃料的是_____(填物质的序号);
(2)一个C分子是由_____构成的;
(3)写出反应A+D→B+C的化学方程式:_____.
【题目】在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量关系,能用如图图像表示的是
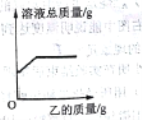
序号 | 甲 | 乙 |
① | 稀盐酸 | 金属铁 |
② | 稀硫酸 | 氢氧化铁 |
③ | 氯化钠溶液 | 硝酸银溶液 |
④ | 硝酸钾溶液 | 碳酸钠溶液 |
A.①②B.②③C.①②④D.①③④