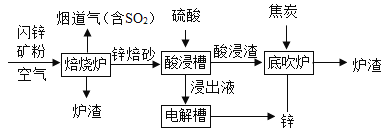
题目内容
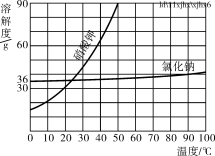
【题目】为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取100g该混合酸,逐滴滴加某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图1所示.
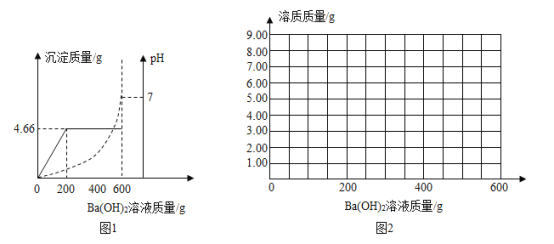
(1)当加入的氢氧化钡溶液为______g时,混合酸恰好被中和.
(2)求Ba(OH)2溶液中的溶质质量分数是多少?_____(写出计算过程,结果精确到0,01%)
(3)盐酸的溶质质量分数是______.(结果精确到0.01%)
(4)请在图2中画出向100g该混合酸中加入600g Ba(OH)2溶液的过程中,混合酸中,生成溶质的质量与所加的Ba(OH)2溶液的质量关系图._____
【答案】(1)600;(2)1.71%;(3)2.92%;(4)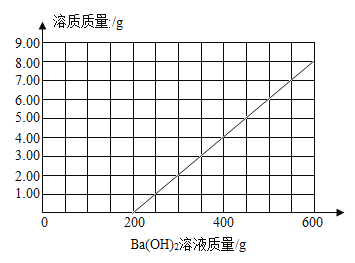
【解析】
向盐酸和硫酸的混酸中滴加氢氧化钡溶液,氢氧化钡先和硫酸反应生成硫酸钡沉淀和水,待硫酸反应完后,氢氧化钡再和盐酸反应生成氯化钡和水。
(1)由图示可知,当加入的氢氧化钡溶液为600g时,pH值等于7,混合酸恰好被中和;
(2)由图示可知,生成沉淀的最大量为4.66g,
设恰好完全反应时,消耗Ba(OH)2的质量为x,
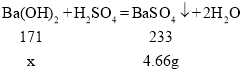
![]()
x=3.42g
Ba(OH)2溶液的溶质质量分数是:![]() ×100%=1.71%;
×100%=1.71%;
(3)设盐酸的溶质质量分数是y,生成氯化钡质量为z
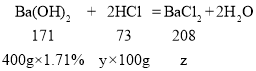
![]()
y=2.92%
z=8.32g
答:盐酸的溶质质量分数是2.92%;
(4)通过上面的反应原理可知氢氧化钡和硫酸反应生成硫酸钡沉淀和水,开始不会生成溶质,盐酸和氢氧化钡反应生成氯化钡和水,溶质质量不断增加,待盐酸反应完后,生成溶质的质量不变,所以得到图像为:


 新题型全程检测期末冲刺100分系列答案
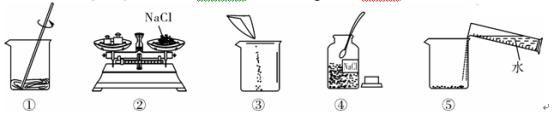
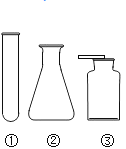
新题型全程检测期末冲刺100分系列答案【题目】以下是实验室常用部分仪器:
![]()
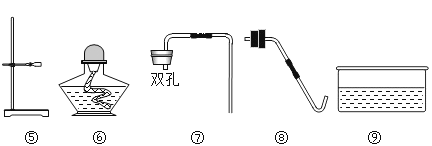
(1)图中仪器④的名称是:____________ ;
(2)小李同学选择仪器制取并收集氧气,他使用了仪器②③④⑨,那么他还需要使用上图中的___________填序号);该发生装置检查气密性的方法是:关闭④的活塞,把导管的一端浸在水里,用手紧贴锥形瓶外壁,若导管口有____________,则说明该装置不漏气。
(3)小张同学正在收集一瓶 CO2, 不知是否收集满了,其验满方法是___________。
(4)小王选用上述仪器,用锌粒和稀硫酸制氢气,锌粒反应完后,发现还有较多的灰黑色固体物质,从反应后的混合物中分离得到该灰黑色固体的操作方法是____________。
(提出问题)灰黑色固体物质的成分是什么呢?
(提出猜想)可能含有单质碳
(设计实验)请设计实验用化学方法证明该灰黑色固体物质中是否含有单质碳。
实验方法 | 现象和结论 |
________________ | ________________ |