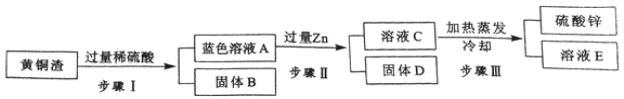
题目内容
【题目】(8分)Mg与NH4Cl溶液反应,除生成一种盐外,还有气泡产生。为确定气体的成分,进行下列实验探究:
【假设与猜想】气体可能是HCl,NH3,H2中的一种或几种。
【查阅资料】
①NH3+HCl=NH4Cl ②NH3+H2SO4= (NH4)2SO4 ![]()
【实验探究】
(1)为确定是否含有HCl,将气体通入酸化的 溶液中,无沉淀产生,则该气体中无HCl。
(2)为了探究其他气体是否存在,又设计了如下实验装置:
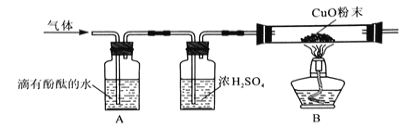
①A中观察到 ,证明有NH3;
②B中玻璃管内观察到____________证明有H2;
③浓硫酸的作用是________________。
【实验结论】Mg与NH4Cl溶液反应生成盐,NH3和H2 。写出化学方程式 。
【实验反思】综合以上信息和实验结论,有同学认为不需要单独检验HCl,就能证明HCl不存在。请评价这种说法是否合理 (填“是”或“否”),理由是 。
【答案】(1)硝酸银;
(2)①酚酞试液变红色;②黑色铜粉变为红色;在玻璃管末端有水雾出现;③吸收多余氨气;干燥气体;
【实验结论】Mg+2NH4Cl![]() MgCl2+2NH3↑ +H2 ↑;
MgCl2+2NH3↑ +H2 ↑;
【实验反思】是;氨气和氯化氢气体反应产生白烟。
【解析】
试题分析:(1)检验溶液中的氯离子用酸化的硝酸银溶液;(2)①根据结论含有氨气,氨气溶于水溶液显碱性,故溶液变为红色;②结论有氢气,氢气具有还原性,产生水蒸气,故观察到黑色铜粉变为红色;在玻璃管末端有水雾出现;③浓硫酸的作用是收多余氨气;干燥气体;【实验结论】Mg与NH4Cl溶液反应生成盐,NH3和H2,化学方程式为Mg+2NH4Cl![]() MgCl2+2NH3↑ +H2 ↑;【实验反思】因为氨气和氯化氢气体反应能产生白烟,故不需要特意检验氯化氢气体。
MgCl2+2NH3↑ +H2 ↑;【实验反思】因为氨气和氯化氢气体反应能产生白烟,故不需要特意检验氯化氢气体。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
①下表是KNO3、KNO3在不同温度下的溶解度(单位:g/100g水)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
KNO3 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
I.上表中的两种物质在40℃时, 的溶解度较大;请用相应的数据列式表示该温度是KNO3饱和溶液的质量分数 (不要求计算)。
II.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法 。
III.20℃时,将20gNaCl放入50g水中,所得溶液的质量是 g。
IV.从NaCl溶液中得到NaCl晶体的方法是 。
②用硫酸铜进行如下图所示的实验,完成下列填空 (用编号表示)。
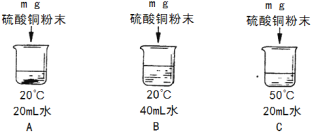
所得三个溶液中:一定属于饱和溶液的是 ,溶液中溶剂质量的大小关系是 。