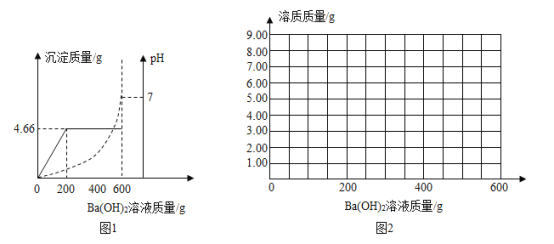
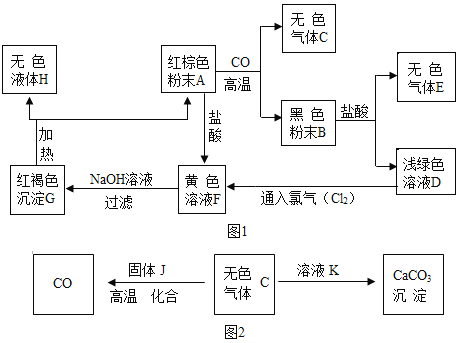
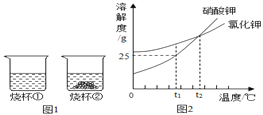
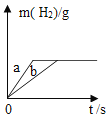
题目内容
【题目】(7分)下列是小明同学配制100 g 10% NaCl溶液的实验操作示意图。
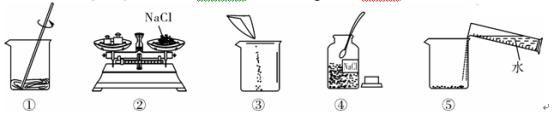
(1)该实验正确的操作顺序是____________(填序号)。
(2)认真观察指出图中错误的操作步骤________(填序号)。
(3)配制该溶液需要NaCl固体________g,需要水________mL(ρ水=1 g/mL)。
(4)小明同学将称量完毕的食盐转移到烧杯里时,不慎将少量食盐洒落在桌面上,这样会使所配制的溶液中溶质质量分数________10%(填“>”“=”或“<”)。
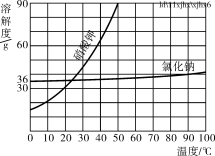
(5)部分物质溶解度曲![]() 线如右图所示,在20 ℃时,将40 g NaCl固体加入到100 g水中,搅拌使其充分溶解,你认为所得NaCl溶液的质量是________g,溶质质量分数是________%(精确到0.1%)。
线如右图所示,在20 ℃时,将40 g NaCl固体加入到100 g水中,搅拌使其充分溶解,你认为所得NaCl溶液的质量是________g,溶质质量分数是________%(精确到0.1%)。
【答案】(1)④②③⑤① (2)② (3)10 90 (4)< (5)136 26.5
【解析】(1)根据配制溶质质量分数一定的溶液的基本步骤考虑;(2)根据用天平称量物质的注意事项考虑;(3)溶质质量=溶液质量×溶质质量分数,溶剂质量=溶液质量-溶质质量;(4)根据溶质质量分数的计算方法考虑;(5)根据溶解度考虑加入的溶质是否全部溶解再进行计算.
解:(1)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放;
(2)称量时左物右码,氯化钠不能直接放到托盘上;
(3)氯化钠质量:100g×10%=10g,需水:100g-10g=90g,水水体积:![]() =90mL;
=90mL;
(4)不慎将少量食盐洒落在桌面上,溶质少了,导致溶质质量分数小了;
(5)20℃时,NaCl溶解度为36g说明100g水中最多溶36g,所以溶液质量为36g+100g=136g,溶质质量分数为:![]() ×100%=26.5%
×100%=26.5%
故答案为:(1)④②③⑤①(2)②(3)10 90 (4)<(5)136 26.5

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案【题目】在“宏观﹣微观﹣符号”之间建立联系,是学习化学的一种重要的思维方式.如图是元素周期表中部分元素的原子结构示意图,根据所学知识回答下列的问题.
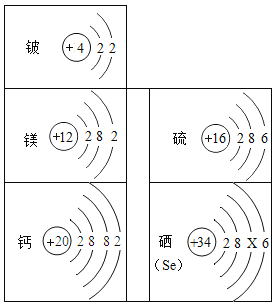
(1)硒原子结构示意图中的X=____,硒元素属于______(填“金属”或“非金属”)元素.
(2)硬水中含有的金属离子为________(填离子符号).
(3)硫元素和硒元素的化学性质相似,所以硒酸的化学式为________.
(4)相对分子质量与标准状况下的气体体积之间存在紧密的关系(见下表),根据下表判断,标准状况下22.4L氮气的质量Y为______.请根据下表归纳出一条规律:______.
氢气 | 氧气 | 氮气 | |
相对分子质量 | 2 | 32 | 28 |
标准状况下,22.4L气体的质量 | 2g | 32g | Y |