题目内容
【题目】高铁的开通对丹东的发展起到极大的推动作用。高铁建设需要大量的钢铁材料.
(1)工业炼铁的原理方程式是_________(以赤铁矿为例)
(2)锰钢是一种合金,可用于高铁建设。已知金属活动性:锰>铁.锰的部分化合物溶解性见右表。若用实验验证铁、铜、锰三种金属的活动性,至少需要的三种试剂是_________
OH- | NO3- | Cl - | SO42- | CO32- | |
Mn2+ | 不 | 溶 | 溶 | 溶 | 不 |
(3)已知铁的硬度为5,锰的硬度为6,锰钢的硬度__(填“>6”、“<5”或“介于5-6之间”).
【答案】Fe2O3 + 3CO![]() 2Fe+3CO2 硫酸锰溶液、硫酸铜溶液、铁(合理答案均可) >6
2Fe+3CO2 硫酸锰溶液、硫酸铜溶液、铁(合理答案均可) >6
【解析】
(1)赤铁矿的主要成分是氧化铁,在高温的条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3 + 3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)在金属活动性顺序中,氢之前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,设计实验证明金属的活动性顺序,可以使用活动性居中的金属为单质、强和弱的金属为盐溶液的方法,或是活动性居中的金属为盐海液,强和弱的金属为单质的方法,也可以使用加酸观察是否产生气体的方法。因此可以选择硫酸锰溶液、硫酸铜溶液和铁;或锰、铜和硫酸亚铁溶液;
(3)一般合金的硬度大于其组成中纯金属的硬度,所以锰钢的硬度大于铁与锰的硬度,即锰钢的硬度>6。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】某校化学活动小组准备测定生成O2 的体积并探究影响反应速率的因素。
(实验一)通过下列实验,利用二氧化锰粉末与过氧化氢溶液反应来测定生成 O2 的体积。
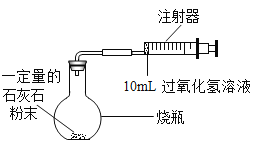
(1)实验中,先连接好装置后检查装置的气密性,然后装好药品,最后将 10mL 过氧化氢溶液_______(填“快速”或“缓慢”)推入烧瓶中,如果不这样操作,则可能造成的后果是_________。
(实验二)探究 H2O2 质量分数、溶液 pH、温度对反应速率的影响。设计如下表实验方案:
实验序号 | H2O2 质量分数 | pH | 温度/℃ | 30s 内收集到氧气的体积 |
1 | 25 | 5 | 20 | |
2 | 25 | 6 | 20 | |
3 | 25 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
(2)实验 1~3 的实验目的是_____。
(3)a=_____;b=_____。
(实验三)探究催化剂对化学反应速率的影响:
取 5mL 溶质质量分数相同的 H2O2 溶液,三次实验分别加入质量均为 0.5gMnO2、红砖粉末、CuO 进行实验,记录收集相同体积氧气所用时间的数据如下:
试剂
MnO2
红砖粉末
CuO
时间/s
10
60
20
由此得出结论:MnO2、CuO 对 H2O2 分解有催化作用,红砖粉末无催化作用。
(4)你认为该结论是否正确?_____(填“正确”或“不正确”),为什么?_____。