题目内容
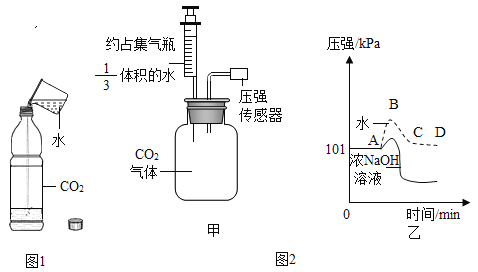
【题目】我国的煤炭资源丰富,但液体燃料短缺。通过“煤液化”技术,用煤炭和水制取甲醇(CH3OH)对我国具有重要意义。主要流程如下:
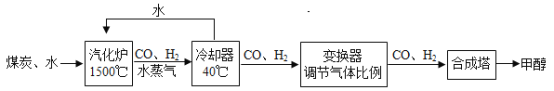
(1)冷却器里发生的是_____ (填“物理”成“化学”)变化。
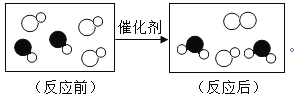
(2)合成塔中发生反应的微观示意图如下,请在方框内补全相应微粒的图示。_____
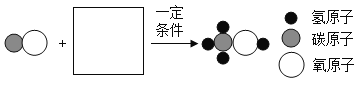
(3)下列关于甲醇生产的说法中,合理的是_____ (填字母序号)
A 根据信息推测,甲醇是一种液体燃料
B 煤炭与水在常温下即可生成CO和H2
C 甲醇的生产会受到CO和H2比例的影响
(4)甲醇(化学式: CH3OH)是一种重要的工业原料。甲醇由_____种元素组成;碳、氢元素的物质的最之比为_____;甲醇的摩尔质量是_____;甲醇中碳元素的质量分数为_____;3.2g 甲醇中含_____个甲醇分子。
【答案】物理  A、C 三或3 3:1 32g/mol 37.5%
A、C 三或3 3:1 32g/mol 37.5% ![]()
【解析】
(1)冷却器中没有新物质生成,属于物理变化;
(2)合成塔中发生的变化是一氧化碳和氢气在一定条件下反应生成甲醇,所以合成塔中发生反应的微观示意图为:
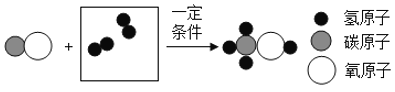 ;
;
(3)A、甲醇中含有碳元素,转化过程是将煤液化,所以推测甲醇是一种液体燃料,故正确;
B、碳和水在高温的条件下生成一氧化碳和氢气,故错误;
C、一氧化碳和氢气在一定条件下生成甲醇,所以甲醇的生产会受到一氧化碳和氢气比例的影响,故正确;
故选:AC;
(4)甲醇![]() 由碳、氢、氧三(或3)种元素组成;碳、氢元素的物质的量之比为
由碳、氢、氧三(或3)种元素组成;碳、氢元素的物质的量之比为![]() ;甲醇的相对分子质量为
;甲醇的相对分子质量为![]() ,故其摩尔质量是32g/mol;甲醇中碳元素的质量分数为
,故其摩尔质量是32g/mol;甲醇中碳元素的质量分数为![]() ;3.2g 甲醇中含
;3.2g 甲醇中含![]() 个甲醇分子。
个甲醇分子。

【题目】高铁的开通对丹东的发展起到极大的推动作用。高铁建设需要大量的钢铁材料.
(1)工业炼铁的原理方程式是_________(以赤铁矿为例)
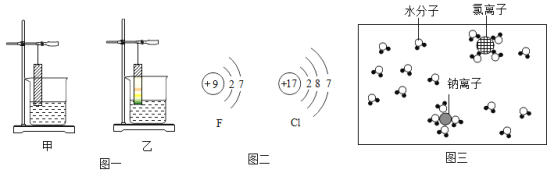
(2)锰钢是一种合金,可用于高铁建设。已知金属活动性:锰>铁.锰的部分化合物溶解性见右表。若用实验验证铁、铜、锰三种金属的活动性,至少需要的三种试剂是_________
OH- | NO3- | Cl - | SO42- | CO32- | |
Mn2+ | 不 | 溶 | 溶 | 溶 | 不 |
(3)已知铁的硬度为5,锰的硬度为6,锰钢的硬度__(填“>6”、“<5”或“介于5-6之间”).
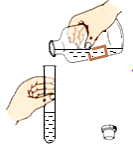
【题目】小强看到妈妈将某品牌洗净剂(主要成分是过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后有气泡冒出。为了解其反应过程,他与学习小组的同学进行了如下探究。
探究I :气体成分探究
[实验装置]
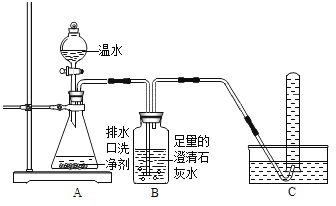
[实验现象]A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。
[得出结论]生成的气体是_______________。
探究Ⅱ:为探究过碳酸钠溶于水后所得溶液中的溶质成分,同学们找来过碳酸钠进行实验.
[实验背景]取少量过碳酸钠试剂溶于温水中,发现有气泡缓缓冒出,形成无色溶液X;取少量溶液X加入MnO2 ,发现迅速产生大量气泡,用带火星木条放在管口,木条复燃。
[提出问题]无色溶液X中的溶质有哪些物质?
[猜想假设]X溶液中一定存在的溶质是________________,还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种。
[查找资料]①氯化钙溶液与碳酸氢钠溶液混合不发生反应;②NaHCO3溶液呈碱性,能与澄清石灰水反应生成白色沉淀。
[实验过程]学习小组同学对溶液X中的溶质进行了如下实验。请将下列实验方案填写完整。
实验步骤 | 主要实验现象 | 结论 |
①取样,滴加过量氯化钙溶液 | ________________ | 证明溶液中有Na2CO3 |
②取①所得上层清液,滴 加________溶液 | 无白色沉淀产生 | 证明溶液中无NaHCO3 |
③重新取样,加入过量氯化钙溶液,充分反应后滴加酚酞试液 | ________________ | 证明溶液中无NaOH |
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如右图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。

【进行猜想】猜想Ⅰ:该溶液的溶质是NaCl;
猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;
猜想IV:该溶液的溶质是NaHCO3.
【查阅资料】常温下物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3,因为常温下NaHCO3溶液溶质的质量分数最大是
(精确到01.%)。
【进行实验】
(1)测定溶液的pH大于7,该溶液的溶质不是 (填化学式)。
(2)同学们又进行了如下实验,实验过程如下:
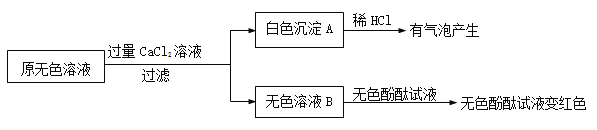
①产生白色沉淀的化学方程式是 。
②实验可以判断原无色溶液中含有的溶质有 。
【获得结论】
该瓶原来装的无色溶液的溶质是NaOH,并且 (填“没有”、“部分”或“全部”)变质。
【拓展】
提纯该无色溶液的步骤是:先向无色溶液中加入适量的 ,然后过滤。反应化学方程式是 。
【题目】某化学兴趣小组的同学对实验室一瓶长时间敞口放置的氢氧化钠进行了成分探究。
[预检]小组同学取出少量样品于烧杯中,滴加过量稀盐酸,有气泡产生,证明该样品已经变质。氢氧化钠敞口放置变质的原因是________(用化学方程式表示)。
[提出问题]样品的成分是什么?
[做出猜想]猜想一:部分变质: NaOH和Na2CO3
猜想二:完全变质:_______。
有同学提出:把样品溶于水,然后滴加酚酞,若变红色即可证明还有NaOH存在,样品便为部分变质。立即遭到了其他同学的反对,你认为其他同学反对的理由是______。
[实验探究]
为了进一步确定样品成分,同学们取了部分样品溶于水形成溶液, 做了如下探究:
实验步骤 | 实验记录 | 结论 |
步骤Ⅰ:取少量溶液,向其中滴入过量CaCl2溶液,并过滤; 步骤Ⅱ:取过滤后的滤液,向其中滴入几滴酚酞试液,并观察现象。 | 步骤Ⅱ的现象为______ | 猜想一不成立 |
[反思与拓展]步骤Ⅰ的目的是除去混合物中的Na2CO3,避免对NaOH的检验造成干扰。最后有同学提出可以用Ca(OH)2溶液代替CaCl2溶液,你是否同意?______(填“是“或“否”);理由是______。