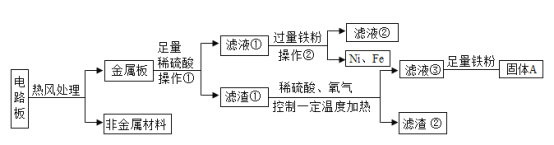
题目内容
【题目】利用下图装置可在实验室制取氢气、氧气、二氧化碳气体。


(1)既可用A装置又可用B装置制取的气体是________,写出用A装置制取气体的一个化学方程式______。
(2)既可用B装置又可用F装置制取的气体是_______,与B装置相比,F装置优点是 ______。
(3)要收集体积比为2:1的氢气和氧气的混合气体,应选择的收集装置是______。
(4)加热氯化铵和熟石灰的固体混合物可制取氨气(NH3)。氨气极易溶于水形成氨水,制取氨气应选用的一套装置是_________(填字母代号)。
【答案】氧气(O2) 2KClO3![]() 2KCl+3O2↑ H2、CO2 可控制反应随时发生随时停止 E AD
2KCl+3O2↑ H2、CO2 可控制反应随时发生随时停止 E AD
【解析】
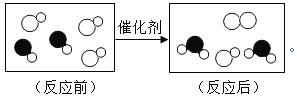
(1)如果用双氧水和二氧化锰制氧气不需要加热,如果用高锰酸钾或氯酸钾制氧气需要加热,既可用A装置又可用B装置制取的气体是氧气(O2);A装置的试管中没有棉花团,因此是加热氯酸钾制氧气,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(2)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取,不需要加热;实验室是用锌粒和稀硫酸在常温下反应制氢气,因此二氧化碳和氢气既可用B装置又可用F装置制取;在装置F中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入。反应后关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。与B装置相比,F装置优点是:可控制反应随时发生随时停止;
(3)要收集体积比为2:1的氢气和氧气的混合气体,应选择的收集装置是排水法,故选E;
(4)加热氯化铍和熟石灰的固体混合物可制取氨气,因此需要加热;氨气极易溶于水、密度比空气小,因为只能用向下排空气法收集;制取氨气应选用的一套装置是AD。

 每课必练系列答案
每课必练系列答案【题目】正确的方案设计和规范的实验操作有助于达到实验目的,请分析或改进以下实验。
实验目的 | 实验过程及现象 | 分析或改进 |
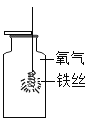
铁丝在氧气中燃烧 |
| 画图表示你的改进方法:_____。 |
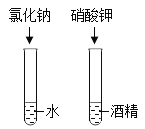
探究物质溶解性的影响因素 |
| 为达到实验目的,你的改进方法是_____。 |
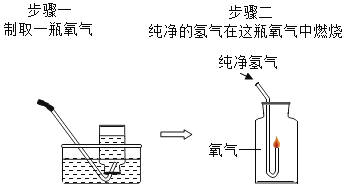
通过氢气在氧气中燃烧证明水的组成 |
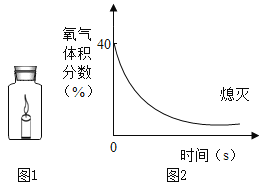
现象:氢气燃烧,发出_____色火焰, 瓶壁发热。 | 该实验不能达到实验目的的原因是_____。 |
【题目】高铁的开通对丹东的发展起到极大的推动作用。高铁建设需要大量的钢铁材料.
(1)工业炼铁的原理方程式是_________(以赤铁矿为例)
(2)锰钢是一种合金,可用于高铁建设。已知金属活动性:锰>铁.锰的部分化合物溶解性见右表。若用实验验证铁、铜、锰三种金属的活动性,至少需要的三种试剂是_________
OH- | NO3- | Cl - | SO42- | CO32- | |
Mn2+ | 不 | 溶 | 溶 | 溶 | 不 |
(3)已知铁的硬度为5,锰的硬度为6,锰钢的硬度__(填“>6”、“<5”或“介于5-6之间”).