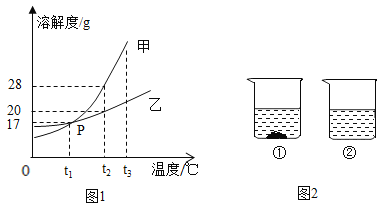
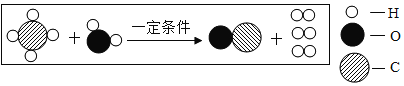
题目内容
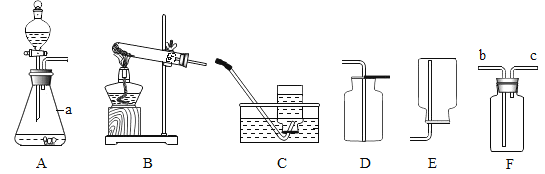
【题目】用如图装置进行实验。实验时,先将浓氢氧化钠溶液挤入盛有CO2的试管中,振荡;然后将止水夹K打开。
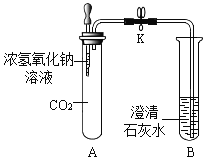
(1)A中发生反应的化学方程式为_____。
(2)打开止水夹K后,观察到的现象是_____。
【答案】CO2+2NaOH=Na2CO3+H2O B中澄清石灰水流到A中,A中液体变浑浊
【解析】
CO2与碱溶液反应,碳酸盐与澄清石灰水反应生成沉淀,据此解答。
将氢氧化钠浓溶液注入A中氢氧化钠会与CO2反应,其反应方程式为CO2+2NaOH=Na2CO3+H2O,此时CO2被消耗,A 中气压减小,故打开止水夹后B中澄清石灰水会进入A中,此时澄清石灰水会与Na2CO3反应生成碳酸钙沉淀,故可以看到澄清石灰水变浑浊,据此:
(1)注入氢氧化钠浓溶液后,A中发生反应的化学方程式为:CO2+2NaOH![]() Na2CO3+H2O;
Na2CO3+H2O;
(2)打开止水夹,可观察到的现象:B中澄清石灰水流到A中,A中液体变浑浊。

【题目】某校化学兴趣小组的同学在实验室整理化学药品时,发现一瓶金属铬。为了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,他们进行了如下探究活动。
[查阅资料]铬(Cr)是银白色金属,在空气中表面能形成致密的氧化膜
[提出假设]考虑到铝的活动性比铜强,提出了三种假设:
假设①:A1>Cr>Cu
假设②:______。
假设③:____。
[实验过程]取大小相同的Cr、Cu、Al三种金属薄片,用砂纸打磨光亮后,分别放入三支试管中,再分别加入等体积20%的稀硫酸。
[实验现象]
金属 | Cr | Cu | Al |
实验现象 | 铬片表面产生气泡缓慢 | 铜表面无明显变化 | 铝表面产生 气泡较快 |
[实验结论]假设____成立(填序号)。
[问题与反思]
(1)由上述结论可知:铬可以与硫酸铜溶液发生反应。请写出该反应的化学方程式:____(已知在该反应的生成物中铬元素显+2价)。
(2)小丽提出,按上述实验操作,用硫酸铜溶液代替稀硫酸也能得出三种金属的活动性顺序,你认为____(填“可行 ”或“不可行”),理由是____。
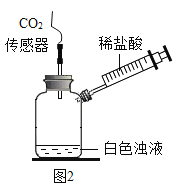
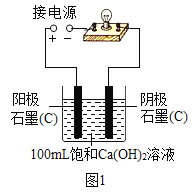
【题目】实验小组同学验证Ca(OH)2溶液导电性的实验装置如图1所示。实验观察到灯泡变亮的同时,两个电极上均有气体产生,且阳极附近出现了白色浑浊。小组同学对白色浑浊物的成分进行了如下探究。
(猜想一)甲同学认为:白色浑浊物是Ca(OH)2。
(实验一)为了验证甲同学的猜想,进行如下实验。取少量白色浊液于试管中,加入足量水,充分振荡,观察到仍有白色浑浊。
(猜想二)乙同学认为:白色浑浊物中含有CaCO3。
(实验二)为了验证乙同学的猜想,进行如下实验。取少量白色浊液于试管中,滴加稀盐酸,白色浑浊消失,没有观察到有气泡产生。
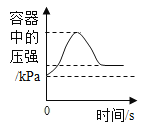
(实验三)为了进一步验证乙同学的猜想,进行如下实验。
实验装置图 | 实验操作 | 实验现象 |
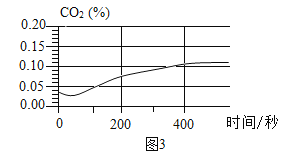
| 将注射器内稀盐酸推入瓶中,并用二氧化碳传感器测得装置内二氧化碳的体积分数 | I.白色浑浊消失,没有观察到有气泡产生 II.检测到二氧化碳含量随时间的变化如下图所示
|
(解释与结论)
(1)用石墨电极验证Ca(OH)2溶液的导电性实验时,两个电极上产生大量气体,发生的是电解水的反应,写出反应的化学方程式________。
(2)甲同学提出白色浑浊为Ca(OH)2的理由是_____。
(3)由实验三得出的结论是____,相关反应的化学方程式为____。
(反思与交流)
(4)实验二中没有观察到明显气泡的可能原因是____。
(5)丙同学为了进一步探究白色浑浊物产生的原因,用铂(Pt)电极代替石墨(C)电极完成图1所示实验,其目的是________。
【题目】分析数据,获得信息实验室现有硫酸铜和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸铜的质量分数。先称取该混合物样品 25g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液 100g 平均分四次加入其中,充分振荡,相关实验数据记录如下:
第1次 | 第2次 | 第3次 | 第4次 | |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 4.9 | 9.8 | X | 14.7 |
请回答下列问题:
(1)上表中 X 的数值为_____________;
(2)计算原固体混合物样品中硫酸铜的质量分数为_____________? (写出计算步骤)