题目内容
【题目】中国科学院科研团队研究成果表明,在常温、常压和可见光条件下,基于LDH(一种固体催化剂)合成氨气(NH3)的原理如图所示。下列说法不正确的是
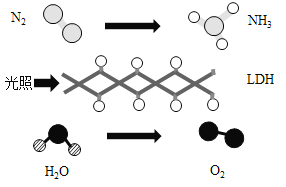
A.四种物质中有一种属于氧化物
B.原料气N2可通过分离液态空气获得
C.参加反应的N2与生成的O2质量比为7:8
D.参加反应的N2与H2O的分子个数比为1:3
【答案】C
【解析】
根据微观示意图可知,反应的化学方程式2N2+6H2O![]() 4NH3+3O2。
4NH3+3O2。
A、在四种物质中,水是由氢、氧两种元素组成的化合物,属于氧化物,选项说法正确;
B、由于空气中主要是氮气和氧气,而氧气和氮气的沸点不同,所以可以通过分离液态空气的方法获得氮气,选项说法正确;
C、发生反应为2N2+6H2O![]() 4NH3+3O2,其中参加反应的N2与生成的O2质量比为(28×2):(32×3)=56:96=7:12,选项说法错误;
4NH3+3O2,其中参加反应的N2与生成的O2质量比为(28×2):(32×3)=56:96=7:12,选项说法错误;
D、由化学方程式2N2+6H2O![]() 4NH3+3O2可知,参加反应的N2与H2O的分子个数比为2:6=1:3,选项说法正确。
4NH3+3O2可知,参加反应的N2与H2O的分子个数比为2:6=1:3,选项说法正确。
故选C。

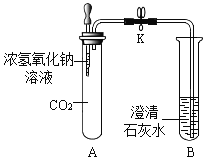
【题目】某化学兴趣小组的同学在做“二氧化碳的实验室制取及性质”实验时,发现长时间向澄清石灰水中通入二氧化碳,石灰水先变浑浊,后又变澄清,加热澄清的液体又变浑浊。请教老师后知道:难溶的碳酸钙能与二氧化碳和水反应,生成易溶解的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2。碳酸氢钙受热易分解:Ca(HCO3)2 ![]() CaCO3↓+H2O+CO2↑。他们对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓厚的兴趣。
CaCO3↓+H2O+CO2↑。他们对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓厚的兴趣。
(提出问题)
一定量CO2与NaOH溶液反应后的溶液中溶质组成是什么?
(查阅资料)
(1)通入少量CO2,反应的化学方程式为: __________________;
(2)通入过量CO2,反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3;
(3)碳酸氢盐都是可溶于水的,BaCO3难溶于水。
(提出猜想)
(1)溶质为Na2CO3;
(2)溶质为NaHCO3;
(3)溶质为NaOH和Na2CO3;
(4)溶质为___________(填化学式)。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
A. 取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液 | 有____生成 | 猜想(2)不成立 |
B. 取步骤a中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(3)不成立 |
(得出结论)
猜想(4)成立。
(讨论交流)
试写出NaHCO3受热分解的化学方程式: ___________。
【题目】化学兴趣小组的同学将镁条放在热水中煮沸,趁热取出部分溶液,滴加酚酞试液,溶液变为红色,放置在空气中一段时间后,发现溶液的红色褪去。为了弄清楚红色褪去的原因进行了下列探究活动:查阅资料:镁可与热水反应生成氢气和氢氧化镁。该反应的化学方程式为_____。
三位同学分别对红色褪去的原因作出如下猜想:
甲:可能是实验所用的酚酞试液变质造成的;
乙:溶液可能与空气中的物质发生了反应;
丙:氢氧化镁的溶解度随温度的降低而减小。
(1)同学们根据实验现象认为甲猜想不正确,理由是____。
(2)同学设计如下实验来验证乙猜想,实验记录如下表。
实验方法 | 实验现象 |
将上述红色溶液在空气中恒温放置一段时间 | 红色不褪去 |
将上述红色溶液在隔绝空气条件下恒温放置一段时间 | 红色不褪去 |
由该实验可知乙猜想______(填“正确”或“不正确”)
(3)若丙猜想是正确的,请设计实验证明,完成下表。
实验方法 | 实验现象 |
将上述红色溶液恒温放置一段时间 | 红色不褪去 |
____ | _____ |
(4)反思:
①请解释为什么在家里将自来水烧开倒入晾水杯中,开始杯中无沉淀物,一段时间后会在杯里看到白色沉淀物_____。
②请从微观角度解释为什么在热水中氢氧化镁可以使酚酞变红而在冷水中不可以_____。
【题目】下图A、B两个实验均可用于空气中氧气含量的测定。
小资料:铁粉与氧气、水常温下反应发生锈蚀,氯化钠、活性炭会加速该反应。
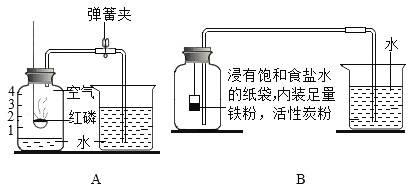
(1)红磷燃烧反应的化学方程式为_____
(2)实验A中,当红磷熄灭,温度冷却到室温后,打开止水夹,观察到烧杯中的水会倒流入集气瓶中,其原因是_____。
(3)图B所示实验中,测得的数据如下:
项目 | 实验前烧杯中水的体积 | 实验后烧杯中水的体积 | 集气瓶的容积 |
体积/mL | 160 | 108 | 250 |
该实验中测得的氧气的体积分数为_____(写出计算式即可)。