题目内容
17.某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
实验Ⅰ:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量.
实验Ⅱ:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥型瓶口塞上橡皮塞,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成)
过一会再称量.数据见表:
| 编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
(2)实验Ⅱ中发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
(3)这三个实验中,实验Ⅲ正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因反应前后,原子种类不变,原子总个数不变,原子的质量不变.
(4)实验Ⅰ、Ⅱ不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路实验Ⅱ中,不当之处是反应装置是敞开的;应该改进为:把锌粒和稀盐酸放在密闭容器中.
分析 化学反应遵循质量守恒定律,即参加反应的物质的质量和等于反应后生成的物质的质量和.
解答 解:(1)因为反应后生成的氧化镁的质量等于反应的镁和氧气的质量之和,所以反应后质量增加.故填:反应后生成的氧化镁的质量等于反应的镁的质量和反应的氧气质量的和.
(2)锌和稀盐酸反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑.
(3)实验Ⅲ正确的原因是:反应前后,原子种类不变,原子总个数不变,原子的质量不变.
故填:反应前后,原子种类不变,原子总个数不变,原子的质量不变.
(4)实验Ⅱ中,不当之处是反应装置是敞开的,应该改进为:把锌粒和稀盐酸放在密闭容器中.
故填:实验Ⅱ中,不当之处是反应装置是敞开的,应该改进为:把锌粒和稀盐酸放在密闭容器中.
点评 化学反应遵循质量守恒定律,这是判断物质化学式、书写化学方程式的基础.

练习册系列答案
相关题目
7.对于化学式H2O2的意义描述错误的是( )
| A. | 表示过氧化氢这种物质 | |
| B. | 表示一个过氧化氢分子由一个氧气分子和一个氢气分子组成 | |
| C. | 表示过氧化氢由氢元素和氧元素组成 | |
| D. | 表示1个过氧化氢分子 |
8.对有关事实的解释中,错误的是( )
| A. | 生铁和钢的性能不同--含碳量不同 | |
| B. | 硫和磷的元素种类不同--质子数不同 | |
| C. | 一氧化碳和二氧化碳的化学性质不同--氧原子个数不同 | |
| D. | 硫在空气和氧气中燃烧的火焰颜色不同--氧气浓度不同 |
12.物质的组成、结构、性质关系归纳错误的是( )
| A. | 核内质子数决定了元素的种类 | |
| B. | 元素的化学性质与原子的最外层电子数关系密切 | |
| C. | 金刚石与石墨的组成元素相同,因此性质完全相同 | |
| D. | 物质由原子、分子、离子等粒子构成 |
2.氢气和氧气的混合气体37g,点燃充分反应生成水36g,则混合气体中氢气和氧气的质量比可能是( )
| A. | 1:36 | B. | 2:35 | C. | 5:32 | D. | 4:33 |
6.空气和水是人类宝贵的自然资源,下列关于空气和水的说法不正确的是( )
| A. | 空气的主要成分是氮气和氧气 | |
| B. | 造成空气污染的主要气体有CO、CO2和SO2等 | |
| C. | 净化水的常用方法有沉淀、过滤、吸附、蒸馏等 | |
| D. | 禁止使用含磷洗衣粉有利于保护水资源 |
7.根据如图的实验,判断下列说法错误的是( )
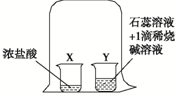

| A. | 说明浓盐酸有挥发性 | B. | 说明分子不断做无规则运动 | ||
| C. | 可观察到Y杯溶液的颜色变化 | D. | 说明氯化氢气体具有酸性 |
