题目内容
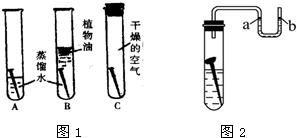
5.水是生命之源,探究水的组成中水电解实验现象:两电极有气泡产生,负极产生气体与正极产生气体体积比:2:1,实验结论:水是由氢元素和氧元素组成的 化学方程式:2H2O $\frac{\underline{\;通电\;}}{\;}$2H2↑+O2 ↑.分析 根据电解水实验现象和结论分析解答:正极产生能使带火星木条复燃的气体,为氧气;负极产生能燃烧的气体,火焰淡蓝色,罩在火焰上干冷烧杯壁有水雾,为氢气;且正负极气体体积比为1:2进行解答.
解答 解:(1)水通电分解正极和负极会出现气泡,正极产生的气体体积较少为氧气,负极产生的气体体积较到为氢气,且过一段时间后,正负极产生的气体体积比约为1:2;说明水是由氢元素和氧元素组成的,水在通电条件下生成氢气和氧气,化学方程式为:2H2O $\frac{\underline{\;通电\;}}{\;}$2H2↑+O2 ↑.
故答案为:有气泡产生;2:1;水是由氢元素和氧元素组成的;2H2O $\frac{\underline{\;通电\;}}{\;}$2H2↑+O2 ↑.
点评 本题详细考查电解水的实验及水的电解的过程,电解水实验可简单记忆为:正氧负氢一比二,并结合相应的实验过程即可轻松解题.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
16.下列各组日常生活中发生的变化,都属于化学变化的是( )
| A. | 酒精燃烧 蜡烛熔化 | B. | 干冰升华 轮胎爆炸 | ||
| C. | 剩饭变馊 高粱酿酒 | D. | 灯泡发光 铁锅生锈 |
20.下列各组物质的俗名与化学式一致的是( )
| A. | 苛性钠KOH | B. | 消石灰Ca(OH)2 | C. | 熟石灰CaO | D. | 干冰CO |
17.某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:

实验Ⅰ:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量.
实验Ⅱ:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥型瓶口塞上橡皮塞,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成)
过一会再称量.数据见表:
(1)在实验Ⅰ中,反应后的质量比反应前明显增加,请用质量守恒定律加以解释反应后生成的氧化镁的质量等于反应的镁的质量和反应的氧气质量的和.
(2)实验Ⅱ中发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
(3)这三个实验中,实验Ⅲ正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因反应前后,原子种类不变,原子总个数不变,原子的质量不变.
(4)实验Ⅰ、Ⅱ不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路实验Ⅱ中,不当之处是反应装置是敞开的;应该改进为:把锌粒和稀盐酸放在密闭容器中.

实验Ⅰ:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量.
实验Ⅱ:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥型瓶口塞上橡皮塞,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成)
过一会再称量.数据见表:
| 编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
(2)实验Ⅱ中发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
(3)这三个实验中,实验Ⅲ正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因反应前后,原子种类不变,原子总个数不变,原子的质量不变.
(4)实验Ⅰ、Ⅱ不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路实验Ⅱ中,不当之处是反应装置是敞开的;应该改进为:把锌粒和稀盐酸放在密闭容器中.
15.氯化钠是由钠离子和氯离子构成的.已知钠离子(Na+)的原子核中质子娄为11,中子数为12,下列有关Na+的说法正确的是( )
| A. | 原子核外电子数为11 | B. | 它带1个单位的正电荷 | ||
| C. | 原子核内的正电荷数为+10 | D. | 在化学反应中很活泼 |
 下面是实验室制取二氧化碳并验证其性质的实验装置图(Ⅲ中装澄清石灰水,Ⅱ中装置紫色石蕊试液).回答下列问题.
下面是实验室制取二氧化碳并验证其性质的实验装置图(Ⅲ中装澄清石灰水,Ⅱ中装置紫色石蕊试液).回答下列问题. 在“空气中氧气含量的测定”实验探究中,小涵设计了如下实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.(实验装置如图所示)回答下列问题:
在“空气中氧气含量的测定”实验探究中,小涵设计了如下实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.(实验装置如图所示)回答下列问题: