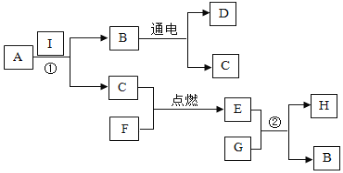
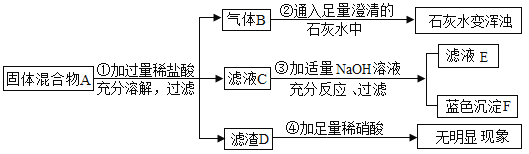
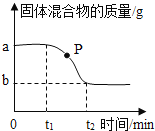
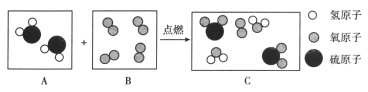
题目内容
【题目】下列图像分别对应的变化过程,正确的

A. ①用两份等温度、等体积、等浓度的双氧水制取氧气
B. ②服用含有氢氧化铝的药物治疗胃酸过多,胃液pH的变化
C. ③常温下,足量的镁和铁分别与等体积、等浓度的稀硫酸反应
D. ④一定量的石灰石中加入稀盐酸,固液混合物中碳元素的质量变化
【答案】C
【解析】
A、催化剂可以改变反应速率,但无法改变生成氧气的质量,故错误;
B、服用含有氢氧化铝的药物治疗胃酸过多,胃酸被中和,胃液pH应该逐渐变大,故错误;
C、常温下,足量的镁和铁分别与等体积、等浓度的稀硫酸反应,镁先于铁完成反应,生成的氢气的质量相等,故正确;
D、一定量的石灰石中加入稀盐酸,生成气体二氧化碳,固液混合物中碳元素的质量逐渐减小,故错误。
故选C

【题目】某兴趣小组对面粉厂悬挂“禁止明火”的宣传感到不解。了解到面粉的主成分是淀粉,属于易燃易爆物,完全燃烧产物为CO2和H2O,为了进一步探究面粉的组成,该小组同学设计了以下实验。
(提出问题)面粉主要由哪些元素组成?
(作出猜想)小明猜想:面粉中一定含有C、H元素,他作出此猜想的依据是:_______
小红猜想:面粉中一定含有C、H、O三种元素。
小文认为小红的猜想错误,因为面粉中是否含有氧元素需要实验验证。
(设计实验)兴趣小组的同学们设计如图所示的实验。
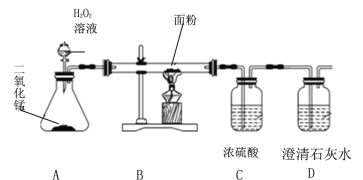
(1)A装置中二氧化锰的作用是___________,发生反应的化学方程式为____________。
(2)打开分液漏斗通入氧气,点燃B处酒精灯。实验现象和结论如下:
实验现象 | 实验结论 |
_______ | ①面粉中含有碳元素 |
B装置硬质玻璃管内壁有水珠出现 | ②面粉中含有氢元素 |
(拓展交流)有同学认为结论②不正确,请说明原因_______
(分析判断)兴趣小组的同学们取面粉8.1 g,使其完全燃烧后测得生成二氧化碳的质量为13.2 g,生成水的质量为4.5 g,由此可以判断出面粉中________(填“含”或“不含”)氧元素。
(反思交流)通过对上述实验分析,为避免事故发生,面粉在生产、运输过程可采取的措施有___。
A 密封门窗,隔绝空气
B 严禁吸烟,杜绝火源
C 轻拿轻放,减少扬尘
D 提高面粉的着火点
【题目】1775年法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,如今我们的化学教育家积极探索、不断创新,先后设计出了如图所示的实验装置。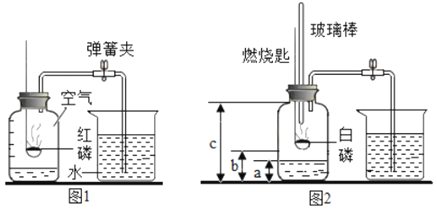
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)______,导致装置内氧气有剩余;(3)……
(实验改进)(1)如图2所示的实验装置进行实验探究。实验前在集气瓶里先装进a体积的水,其作用:一是为了加快集气瓶的冷却速度;二是______。
(2)如图3所示的实验装置进行实验探究。
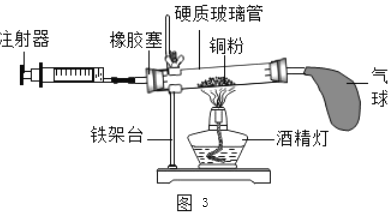
①在实验过程中,不断推拉注射器的目的是______。
②写出该实验中反应的化学方程式______。
③测得实验结果如下(气体体积):(单位:mL)
反应前玻璃管内 | 反应前注射器内 | 反应后注射器内 |
40 | 30 | 18 |
由此数据可以推算出他测定的空气中氧气的体积分数为______。
(实验结论)(1)研究空气的成分实验是在密封容器内进行。
(2)该物质在空气中可以燃烧且只与空气中的氧气反应。
(3)燃烧后的产物______。