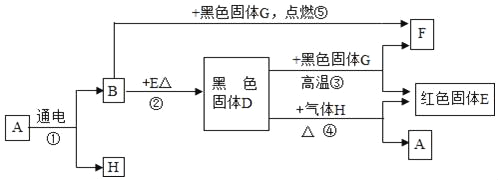
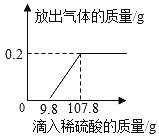
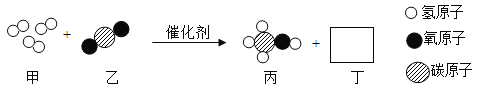
题目内容
【题目】1775年法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,如今我们的化学教育家积极探索、不断创新,先后设计出了如图所示的实验装置。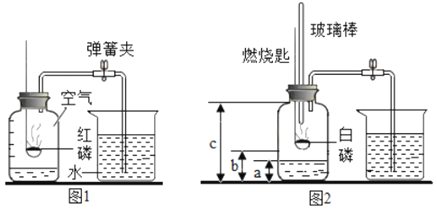
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)______,导致装置内氧气有剩余;(3)……
(实验改进)(1)如图2所示的实验装置进行实验探究。实验前在集气瓶里先装进a体积的水,其作用:一是为了加快集气瓶的冷却速度;二是______。
(2)如图3所示的实验装置进行实验探究。
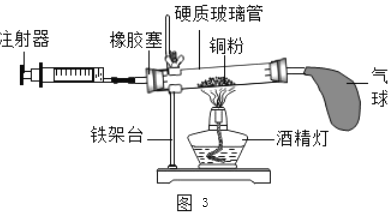
①在实验过程中,不断推拉注射器的目的是______。
②写出该实验中反应的化学方程式______。
③测得实验结果如下(气体体积):(单位:mL)
反应前玻璃管内 | 反应前注射器内 | 反应后注射器内 |
40 | 30 | 18 |
由此数据可以推算出他测定的空气中氧气的体积分数为______。
(实验结论)(1)研究空气的成分实验是在密封容器内进行。
(2)该物质在空气中可以燃烧且只与空气中的氧气反应。
(3)燃烧后的产物______。
【答案】红磷不足 吸收反应生成的五氧化二磷 使氧气充分反应 2Cu+O2![]() 2CuO 17.1% 是固体
2CuO 17.1% 是固体
【解析】
[分析讨论](1)用红磷燃烧的方法测出的氧气含量远低于21%的原因可能是:实验装置漏气;红磷不足,导致装置内氧气有剩余等;
[实验改进](1)其作用:一是为了加快集气瓶的冷却速度;二是吸收反应生成的五氧化二磷;
(2)①在实验过程中,不断推拉注射器的目的是使氧气充分反应;
②该实验中铜和氧气在加热条件下反应生成氧化铜,反应的化学方程式为:2Cu+O2![]() 2CuO;
2CuO;
③由此数据可以推算出他测定的空气中氧气的体积分数为:![]() ×100%=17.1%;
×100%=17.1%;
[实验结论]研究空气的成分实验是在密封容器内进行;该物质在空气中可以燃烧且只与空气中的氧气反应;燃烧后的产物是固体。

【题目】认识燃烧与灭火![]() 为了研究燃烧的奥秘,某同学进行了如下实验:
为了研究燃烧的奥秘,某同学进行了如下实验:
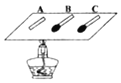
![]() 在铝片上分别放三根火柴,将其中一根去头,分别标记为A、B、
在铝片上分别放三根火柴,将其中一根去头,分别标记为A、B、![]() 如图所示
如图所示![]() ,酒精灯放在去头的火柴A和未去头的火柴B中间,未去头的火柴C放在离酒精灯较远的位置,点燃酒精灯加热,实验时刻观察到B、C依次燃烧,过很长时间A才能燃烧,由B比A先燃烧可知不同物质的______不同,由B比C先燃烧可知可燃物燃烧需要的条件是______.
,酒精灯放在去头的火柴A和未去头的火柴B中间,未去头的火柴C放在离酒精灯较远的位置,点燃酒精灯加热,实验时刻观察到B、C依次燃烧,过很长时间A才能燃烧,由B比A先燃烧可知不同物质的______不同,由B比C先燃烧可知可燃物燃烧需要的条件是______.
![]() 将性状大小相同的木炭在下列气体中燃烧,记录现象如表所示,回答问题:
将性状大小相同的木炭在下列气体中燃烧,记录现象如表所示,回答问题:
不同气体中 | 在空气中 | 在氧气中 | 在臭氧中 |
实验现象 | 红热 | 剧烈燃烧 | 非常剧烈地燃烧 |
生成的气体能使澄清石灰水变浑浊 | |||
![]() 木炭在氧气中燃烧比在空气中更剧烈的微观原因是______.
木炭在氧气中燃烧比在空气中更剧烈的微观原因是______.
![]() 根据表中信息,写一条对“燃烧条件”的新认识______.
根据表中信息,写一条对“燃烧条件”的新认识______.
![]() 结合上述探究过程和平时所学的知识,下列关于燃烧的说法正确的是______.
结合上述探究过程和平时所学的知识,下列关于燃烧的说法正确的是______.
![]() 必须点燃物质才能燃烧;
必须点燃物质才能燃烧;
![]() 纸张比纸团燃烧快是因为纸团里面温度低;
纸张比纸团燃烧快是因为纸团里面温度低;
![]() 油田起火,可通过降低油的着火点的方法来灭火;
油田起火,可通过降低油的着火点的方法来灭火;
![]() 室内起火,迅速打开所有门窗;
室内起火,迅速打开所有门窗;
![]() 面粉厂要严禁烟火,是因为面粉粉尘与空气混合后遇明火可能会发生爆炸;
面粉厂要严禁烟火,是因为面粉粉尘与空气混合后遇明火可能会发生爆炸;
![]() 用扇子扇风可以熄灭蜡烛是因为隔绝了氧气.
用扇子扇风可以熄灭蜡烛是因为隔绝了氧气.