题目内容
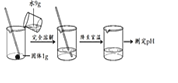
【题目】M是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图1所示,某化学兴趣小组用物质M进行了如图2所示的实验.

(1)t1℃时,氯化铵的溶解度为_____g;
(2)烧杯①中溶质质量分数的计算式为_____;
(3)物质M是_____.
【答案】40 ![]() KNO3
KNO3
【解析】
根据固体的溶解度曲线可以得到:查出某物质在一定温度下的溶解度,从而确定物质的溶解性;比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
(1)t1℃时,由溶解度曲线图可以得到氯化铵的溶解度为40g。故填:40
(2)t1℃时,往150g水中,加入60gM后,M全部溶解,因此,烧杯①中溶质质量分数的计算式为![]() ,故填:
,故填:![]()
(3)由图2可知,当升温并蒸发50g水后,溶液仍为不饱和溶液,由图2②可对比可得,t2℃时100g水可以溶解60g的硝酸钾,而氯化钾则小于60g,若为氯化钾,则应有晶体析出。同时降低温度后,析出较多晶体,故可知M随温度的变化溶解度变化较大。对比图1,可知M为硝酸钾。故填:KNO3

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】碳酸钠和碳酸氢钠是生活中常见的盐,课外小组通过以下实验进行鉴别。
实验1
实验序号 实验操作 | 1-1碳酸钠 | 1-2碳酸氢钠 |
| 11.96 | 8.28 |
实验2
实验序号 实验操作 | 2-1碳酸钠溶液 | 2-2碳酸氢钠溶液 |
|
| |
实验3
实验序号 实验操作 | 3-1碳酸钠溶液 | 3-2碳酸氢钠溶液 |
| 不分解 | 2NaHCO3△ Na2CO3 +CO2 ↑+H2O |
回答下列问题:
(1)实验1中控制的变量是__________,实验1得出的结论是__________。
(2)实验2的目的是__________。
(3) ①实验3-2中观察到的现象是__________。
②完全分解8.4gNaHCO3能生成CO2__________g。
③要确定碳酸氢钠的分解产物,还需进行的实验是__________。
【题目】兴趣小组的同学利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液,探究酸碱盐的性质,小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地得到无色、有刺激性气味的气体.
(提出问题)刺激性气味的气体是什么?
(猜想与假设)猜想1.可能是二氧化硫;猜想2.可能是氯化氢;猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是_____.
(查阅资料)SO2和CO2的化学性质相似都能使澄清石灰水变浑浊,写出二氧化硫和氢氧化钙反应的化学方程式_____;
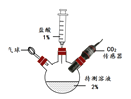
(实验探究)如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到_____,他认为猜想2正确.
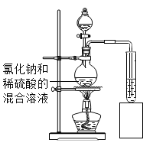
(评价与改进)小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确.
实验操作 | 实验现象 |
如图所示,将产生的气体_____ | 无明显现象 |
为进一步证明结论正确,他们又将该气体通入_____溶液中,观察到了预期的白色沉淀.
(结论)加热氯化钠和硫酸的混合物溶液得到的气体是氯化氢.
【题目】下列观点都是错误的,请你用化学方程式加以说明:
观点 | 化学方程式 |
①氧化反应一定是化合反应 | _____ |
②有盐和水生成反应一定是中和反应 | _____ |
③置换反应一定有金属生成 | _____ |
④碱和盐反应不可能同时产生两种沉淀 | _____ |