��Ŀ����
����Ŀ���ҹ�����������������һ��Ϊ���õķ�չ�춨�˼�ʵ�Ļ�����
��һ����ҵ����
��ҵ���Կ���������ʯ��ʯ��ʯ��_____��д���ƣ�Ϊԭ����ұ��������ʯ��ʯ��������_____������ʯұ��������һ�����ӵĹ��̣�ij�������ó�����������������������Ҫԭ����_____���û�ѧ����ʽ��ʾ����
������������̽��
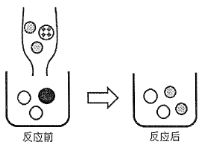
��֪ij����ijɷ�Ϊ Fe2O3xH2O��FeCO3��ij��ȤС���ͬѧ����ʦָ���²ⶨ����ɡ�
���������1������ijɷ���ʲô��
��������ijɷ��Ʋ⣬��Ӧ����˿����е�������ˮ����֮�⣬����_____�μ��˷�Ӧ��
���������2�����ȷ�����������ɣ�
���������ϣ�
��Fe2O3xH2Oʧȥ�ᾧˮ�¶�Ϊ110�棬FeCO3��282��ֽ�ΪFeO��CO2��Fe2O3�� 300��ʱ���ֽ⡣
����ʵ�������£�������̼������ܶ�Ϊ1.80g/L��װ���ڿ����е�ˮ�����Ͷ�����̼��������ݲⶨ��Ӱ��ɺ��Բ��ơ�
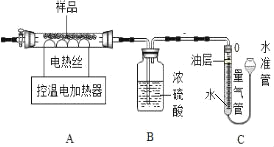
����Ʒ�������ȤС���ͬѧ�������ͼ��ʾ��ʵ��װ�ã��г�����ʡ�ԣ�����ʵ�顣
��Bװ����ҩƷ������
��ʵ�鲽�裩
��������������_____��
��ȡһ������������Ʒ��ȷ�Ƶ�������Ϊ 5.44g��
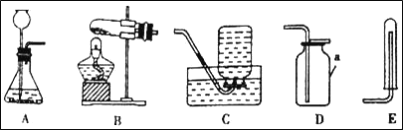
����ͼ��ʾװ��ҩƷ����������¼�������I��
������ A��B��C װ�ã��ر�װ��A�л�����Cװ�ö�������Aװ����300�����ʵ�顣���۲쵽Cװ������_____����ʱ��ֹͣ���ȣ���װ����ȴ���ٴβ�������¼������ݢ�
��������ݣ�
�� | �� | |
A װ�õ�����/g | 55.44 | 53.92 |
B װ�õ�����/g | 102.00 | 103.08 |
C װ�ö���/mL | 0 | 244.4 |
���������ۣ�
��1��װ��B��Ũ�����������_____��
��2����������ˮ���Ϸ��͵�Ŀ����_____��
��3������������������ݣ���FeCO3��������д��������̣���_________
��4���������������ȷ��Fe2O3xH2O��x����_____������ţ���
��A��B װ�÷�Ӧǰ���õ�����
��A��C װ�÷�Ӧǰ���õ�����
��B��C װ�÷�Ӧǰ���õ�����
����չ�������о�һ�������з�ֹ�˵�����Ĵ�ʩ_____��
���𰸡���̿ ����ʯ�еĶ�������ת��Ϊ¯�� 3CO+Fe2O3![]() 2Fe+3CO2 ������̼ ���װ�������� ��������Һ�治���½� ��ȥ�����е�ˮ���� ��ֹ������̼����ˮ 1.16g �٢ڢ� ���ֲ˵������������ͿĨһ��ֲ���ͣ�
2Fe+3CO2 ������̼ ���װ�������� ��������Һ�治���½� ��ȥ�����е�ˮ���� ��ֹ������̼����ˮ 1.16g �٢ڢ� ���ֲ˵������������ͿĨһ��ֲ���ͣ�
��������
��һ����ҵ���Կ���������ʯ��ʯ��ʯ�ͽ�̿Ϊԭ����ұ��������ʯ��ʯ�������ǽ���ʯ�еĶ�������ת��Ϊ¯��������ʯұ��������һ�����ӵĹ��̣�ij�������ó�����������������������Ҫԭ�����ڸ��µ������£�һ����̼����������Ӧ�������Ͷ�����̼�������̿������ʯ�еĶ�������ת��Ϊ¯����3CO+Fe2O3![]() 2Fe+3CO2��
2Fe+3CO2��
������[�������1]����������ijɷ��Ʋ⣬�μӷ�Ӧ�ij��˿����е�������ˮ����֮�⣬���ж�����̼�μ��˷�Ӧ�����������̼��
[ʵ�鲽��]
�����������������װ�������ԡ�������װ�������ԣ�
��ȡһ������������Ʒ��ȷ�Ƶ�������Ϊ 5.44g��
����ͼ��ʾװ��ҩƷ����������¼�������I��
������ A��B��C װ�ã��ر�װ��A�л�����Cװ�ö�������Aװ����300�����ʵ�顣���۲쵽Cװ��������������Һ�治���½�����ʱ��ֹͣ���ȣ���װ����ȴ���ٴβ�������¼�������II�������������Һ�治���½���
[��������]��1��Ũ���������ˮ�ԣ�����װ��B��Ũ����������dz�ȥ�����е�ˮ�����������ȥ�����е�ˮ������
��2����������������������̼����������Ҫ����ֲ���ͷ�ֹ������̼����ˮ�������ֹ������̼����ˮ��
��3�����ɶ�����̼�����Ϊ244.4mL��0.244L��������Ϊ��1.80g/L��0.244L��0.44g
��FeCO3������Ϊx����
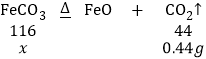
![]()
x��1.16g
��FeCO3������Ϊ1.16g��
��4���������������ȷ����Ʒ��ɵ��ǣ���A��B װ�÷�Ӧǰ���õ����ݣ���A��C װ�÷�Ӧǰ���õ����ݣ���B��C װ�÷�Ӧǰ���õ����ݣ�����٢ڢ���
[��չ]���ֲ˵������������ͿĨһ��ֲ���ͣ����Է�ֹ���⡣������ֲ˵������������ͿĨһ��ֲ���ͣ���

����Ŀ��ijС��ͬѧ��̼�����ơ�̼���ơ��������Ƶ�ijЩ���ʽ���̽����
��������⡿��������Һ������ԣ�
���������ᷴӦʱ��Һ��pH��α仯��
���������ϡ�
pH | 2~3 | 4~6 | 7 | 8��9 | 10��11 | 12��14 |
�ϸ���֭Һ��ʾ����ɫ | �Ϻ� | dz�� | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
��ʵ��1������������Ũ�ȵ�̼�����ơ�̼���ơ�����������Һ�У��ֱ���뼸���ϸ���֭Һ��ͬʱ������ˮ���жԱ�ʵ�飬�۲첢��¼�������£�
Һ������ | ����ˮ | ̼��������Һ | ̼������Һ | ����������Һ |
�ϸ���֭Һ��ʾ����ɫ | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
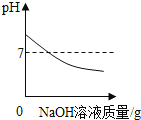
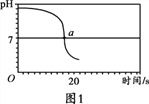
��ʵ��2����һ�������һ��Ũ�ȵ�����������Һ�У���μ���һ��Ũ�ȵ����ᣬ���pH�仯��ʱ��Ĺ�ϵ��ͼ1��ʾ��
��ʵ��3��������������̼ԭ������̼�����ƺ�̼������Һ�У��ֱ���μ���һ��Ũ�ȵ����ᣬ���pH�仯��ʱ��Ĺ�ϵ��ͼ2��ͼ3��ʾ����ͼ2��ͼ3����Ӱ���ֽ��е��ӣ������������غϡ�

����������ۡ�
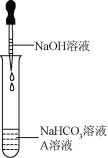
(1)ʵ��1�ó�������Һ�ļ�����ǿ������˳��Ϊ________________��
(2)ʵ��2֤�������������������ᷢ����Ӧ����������_________��ʵ���������Ӧ�����Һ�еμ��ϸ���֭Һ���۲쵽��������_________��
(3)ʵ��3�У�b�������Ϊ_________��c�������Ӧ�Ļ�ѧ����ʽΪ_________��
(4)����ʵ��3��ȡ����Ϣ������Na2CO3��NaHCO3�����ʵ�鷽��Ϊ_________��