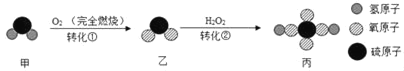
题目内容
【题目】向Ba(OH)2溶液中滴入Na2CO3溶液至恰好完全反应。
(1)可以观察到的实验现象是_____
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。(填离子符号):
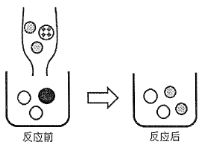
![]() _____
_____![]() _____
_____![]() _____
_____
(3)下列物质中能与Ba(OH)2溶液反应产生沉淀的是_____。(双项选择)
A NaNO3 B HCl C .MgCl2 D (NH4)2SO4
【答案】产生白色沉淀 OH- Ba2+ Na+ CD
【解析】
(1)氢氧化钡溶液与碳酸钠溶液反应生成碳酸钡白色沉淀和氢氧化钠,观察到的实验现象是产生白色沉淀。
(2)向Ba(OH)2溶液中滴入Na2CO3溶液至恰好完全反应,反应的实质是碳酸根离子和钡离子结合生成碳酸钡白色沉淀,则![]() 是Ba(OH)2溶液的钡离子(Ba2+),
是Ba(OH)2溶液的钡离子(Ba2+),![]() 是碳酸钠溶液中的钠离子(Na+),
是碳酸钠溶液中的钠离子(Na+),![]() 是Ba(OH)2溶液中存在的氢氧根离子(OH-)。
是Ba(OH)2溶液中存在的氢氧根离子(OH-)。
(3)Ba(OH)2溶液与NaNO3交换成分没有沉淀、气体或水生成,不能发生复分解反应;
与盐酸发生中和反应生成氯化钡和水;
与MgCl2反应生成氢氧化镁白色沉淀和氯化钡;
与(NH4)2SO4反应生成硫酸钡沉淀和氨气和水。
故答案为:
(1)产生白色沉淀;
(2)OH-;Ba2+;Na+;
(3)CD。

 阅读快车系列答案
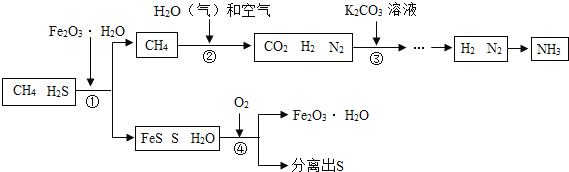
阅读快车系列答案【题目】我国钢铁年产量居世界第一,为国民经济的发展奠定了坚实的基础。
(一)工业炼铁
工业上以空气、铁矿石、石灰石和_____(写名称)为原料来冶炼生铁。石灰石的作用是_____,铁矿石冶炼成铁是一个复杂的过程,某炼铁厂用赤铁矿来炼铁,其炼铁的主要原理是_____(用化学方程式表示)。
(二)铁生锈探究
已知某铁锈的成分为 Fe2O3xH2O和FeCO3,某兴趣小组的同学在老师指导下测定其组成。
(提出问题1)铁锈的成分是什么?
根据铁锈的成分推测,反应物除了空气中的氧气和水蒸气之外,还有_____参加了反应。
(提出问题2)如何确定此铁锈的组成?
(查阅资料)
①Fe2O3xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2,Fe2O3在 300℃时不分解。
②本实验条件下,二氧化碳气体的密度为1.80g/L,装置内空气中的水蒸气和二氧化碳对相关数据测定的影响可忽略不计。
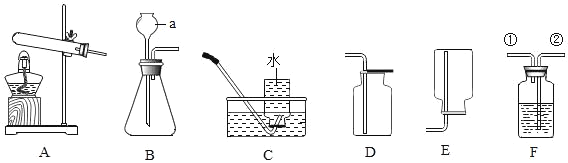
(设计方案)兴趣小组的同学设计了如图所示的实验装置(夹持仪器省略)进行实验。
(B装置中药品足量)
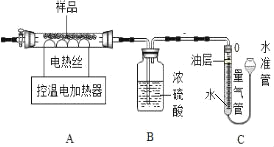
(实验步骤)
①连接仪器,并_____。
②取一定量此铁锈样品,准确称得其质量为 5.44g。
③按图所示装入药品,测量并记录相关数据I。
④连接 A、B、C 装置,关闭装置A中活塞,C装置读数后,控制A装置在300℃进行实验。当观察到C装置中有_____现象时,停止加热,待装置冷却后,再次测量并记录相关数据Ⅱ。
(相关数据)
Ⅰ | Ⅱ | |
A 装置的质量/g | 55.44 | 53.92 |
B 装置的质量/g | 102.00 | 103.08 |
C 装置读数/mL | 0 | 244.4 |
(问题讨论)
(1)装置B中浓硫酸的作用是_____。
(2)量气管中水面上放油的目的是_____。
(3)分析计算测量的数据,求FeCO3的质量(写出计算过程)。_________
(4)下列数据组合能确定Fe2O3xH2O中x的是_____(填序号)。
①A、B 装置反应前后测得的数据
②A、C 装置反应前后测得的数据
③B、C 装置反应前后测得的数据
(拓展)请你列举一条生活中防止菜刀生锈的措施_____。
【题目】纯碱、烧碱等是重要的化工原料。
(1)利用下图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是_____,反应的化学方程式_____。
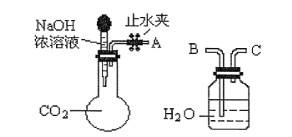
(2)向100mL一定溶质质量分数的NaOH溶液中通入了一定量CO2,充分反应后得到溶液A,在一定条件下使溶液A中的溶质结晶析出,得到少量的白色固体。试设计实验确认该白色固体的成分。
①提出合理假设。
假设1:该白色固体为NaOH和Na2CO3;
假设2:该白色固体为只有Na2CO3;
假设3:该白色固体为_____
假设4:该白色固体为只有NaHCO3;
②基于假设1,设计实验方案进行实验,证明固体的成分是NaOH和Na2CO3。已知BaCl2溶液呈中性,请写出实验操作及预期现象和结论(下列表格中的步骤可以不填满)。限选实验试剂及仪器:蒸馏水、HCl溶液、BaCl2溶液、Ba(OH)2溶液、石蕊试液、酚酞试液、试管、胶头滴管、过滤装置。
实验操作 | 预期现象和结论 |
步骤1:_____ | _____ |
步骤2:_____ | _____ |
步骤3:_____ | _____ |
【题目】(1)实验探究小组的同学欲利用下列仪器验证某混合气体可能含有H2、CO、H2O、HCl中的一种或几种组成。
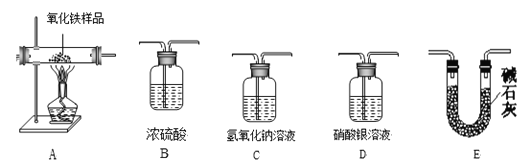
(实验设计) 所选仪器的连接顺序为:混合气体→D→B1→A→B2→C→E(B1、B2均为盛装浓硫酸的试剂瓶)。
(实验及数据)样品充分反应(假设每步均反应完全),并测定部分装置反应前后的质量变化,数据如下:
装置编号 | D | B1 | B2 | C |
试剂 | 硝酸银溶液 | 浓硫酸 | 浓硫酸 | 氢氧化钠溶液 |
现象或质量变化 | 无明显现象 | 增重1.0g | 无增重 | 增重6.6g |
请回答下列问题:
①装置A中能观察到的明显现象是___________________________________;
②装置D的作用是_________________________________;
③根据表格中的现象和数据判断,混合气体中一定不存在的气体是___________;无法确定是否存在的气体是___________,要验证该气体是否存在,应如何改进实验设计______________________________________________;
④从环境保护的角度考虑,针对该套实验装置不足提出改进建议 ____________________。
(2)“84”消毒液在日常生活中使用广泛,化学兴趣小组对一瓶敞口久置的“84”消毒液成分产生兴趣,展开探究。
(查阅资料)“84”消毒液主要成分是次氯酸钠(NaClO)和氯化钠,NaClO为有效成分,有腐蚀性并易与空气中CO2反应(2NaClO+CO2+H2O═2HClO+Na2CO3)。NaClO溶液、HClO都具有漂白、杀菌、消毒功效,HClO不稳定,受热或光照会发生分解。
(分析讨论)小组同学经过讨论,认为该消毒液中的溶质一定有_______,可能还有NaClO、Na2CO3、HClO中的一种或多种。
(实验过程)大家对可能存在的溶质继续进行以下探究:
实验步骤 | 实验现象 | 实验结论 |
1.取适量的该消毒液于试管中,放入有色布条 | 布条长时间不褪色 | ___________ |
2. _____________________ | 生成白色沉淀 | 该消毒液中含有Na2CO3 |
(交流反思)“84”消毒液贮藏时应注意密封保存,其原因可能是____________________。
(拓展延伸)日常生活中“84”消毒液不能与洁厕灵(主要成分为盐酸)混合使用,因为二者混合生成氯化钠、水及有毒的氯气,写出该反应的化学方程式______________________。