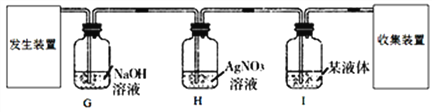
题目内容
【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
【提出问题】①三种溶液的酸碱性?
②它们与酸反应时溶液的pH如何变化?
【查阅资料】
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
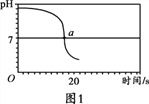
【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。

【解释与结论】
(1)实验1得出三种溶液的碱性由强到弱的顺序为________________。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是_________,实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是_________。
(3)实验3中,b点的溶质为_________,c点后发生反应的化学方程式为_________。
(4)依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为_________。
【答案】 氢氧化钠溶液>碳酸钠溶液>碳酸氢钠溶液 实验过程中溶液的pH由大于7到小于7,说明氢氧化钠被消耗 溶液变为紫红色 NaCl、HCl NaHCO3+ HCl=NaCl+ H2O+CO2↑ 取两种固体加水配成溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠。
【解析】(1)碳酸氢钠溶液使紫甘蓝汁液变蓝,其PH在8~9间,碳酸钠溶液使紫甘蓝汁液变绿,其PH在10~11间,氢氧化钠溶液使紫甘蓝汁液变黄,其PH在12~14间;(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是:实验过程中溶液的pH由大于7到小于7,说明氢氧化钠被消耗;实验结束后,盐酸剩余使溶液显酸性,使紫甘蓝汁液变成紫红色;(3) 碳酸氢钠和盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为:NaHCO3+ HCl=NaCl+ H2O+CO2↑;实验3中,b点说明盐酸过量,溶液中的溶质为:氯化钠、氯化氢;(4) 依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体各根据与盐酸反应产生气体的快慢判断,具体方案为:取两种固体加水配成溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠。

 名师点拨卷系列答案
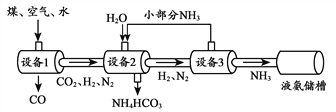
名师点拨卷系列答案【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】(1)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O ![]() CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)
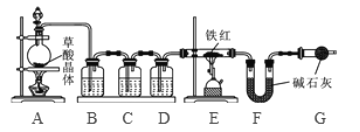
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是________(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 __________________________。
(3)写出E装置中所发生反应的一个化学方程式: _____________________。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 ____ < m < ______。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 _________。
【实验反思】 (1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 ________(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 ___________________。
【题目】锌及其氧化物(ZnO,白色,难溶于水,溶于强酸)具有广泛的应用。
(一)锌的广泛应用
(1)锌被称之为“生命元素”。儿童、青少年如果缺锌严重,将会导致“____ 症”和智力发育不良。经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”。这里的“锌”是指__________。
A.单质 B.元素 C.原子 D.分子
(2)实验室用锌与稀硫酸制取氢气,反应的化学方程式为__________________________。
(3)锌与铜熔合可形成“黄铜”,它属于______(选填序号)。
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
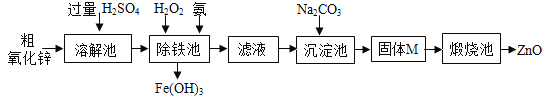
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:
【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见下表。
沉淀物 | Fe(OH)3 | Zn(OH)2 | Fe(OH)2 |
开始沉淀pH | 1.5 | 6.2 | 6.3 |
完全沉淀pH | 3.2 | 8.0 | 9.7 |
【问题探究】
(4)“溶解”前将粗氧化锌粉碎成细颗粒,目的是___________________。
(5)“溶解”后得到的酸性溶液中含有ZnSO4、____、FeSO4。除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为_____________。
(6)“沉淀池”中的沉淀经过滤、洗涤等操作得纯净固体M,其组成为:aZnCO3·bZn(OH)2·cH2O。
确认固体M已经洗涤干净的操作是:取最后一次洗涤液,最好选择下列_______,向其中滴入无现象,则已经洗干净。
A.紫色石蕊试液 B.少量稀盐酸 C.氯化钡溶液或硝酸钡溶液
【组成测定】固体B的组成会影响制得的ZnO的活性。为确定aZnCO3·bZn(OH)2·cH2O的组成,进行如下实验(假设每步反应、吸收均完全):
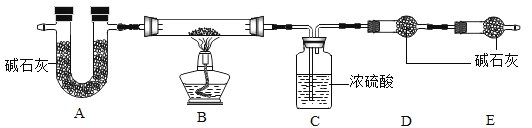
【查阅资料】aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物。
(7)写出装置B中发生反应的化学方程式______________________。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2 g和4.4 g。
【实验分析及数据处理】
(8)该实验反应前后均需要通入空气,反应后通入空气的目的是_______。
(9)装置A的作用是__________________。
(10)根据上述数据,则生成ZnO的质量为______g;a:b:c=________。
(11)若没有E装置,则测得的a值________(填“偏大”、“ 偏小”或“不变”)。