题目内容
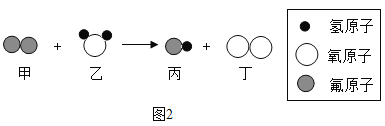
【题目】化学变化通常伴随有能量的变化,其原因是单质和化合物内部都存在有一种能量,即化学能。近年来,研究人员提出利用含硫物质热化学循环实现太阳能的储存与转化。过程如下:
在反应Ⅰ、Ⅱ、Ⅲ中,反应物和生成物均得以循环利用。如反应Ⅱ是反应Ⅰ生成的SO2、H2O及反应Ⅲ生成的SO2发生反应生成H2SO4和S。
(1)在这一方案中,太阳能以_______能的形式储存下来。
(2)反应Ⅰ的化学反应方程式是______________。
(3)反应Ⅲ属于基本反应类型中的________反应。
【答案】电 ![]() 化合反应
化合反应
【解析】
(1)由流程图可知太阳能最后转化成了电能储存下来;
(2)反应Ⅰ是硫酸受热分解为二氧化硫、氧气和水,化学方程式为![]() ;
;
(3)反应Ⅲ是硫和氧气反应生成二氧化硫,由两种物质反应生成一种新物质的反应,属于化合反应。

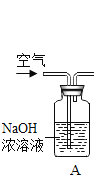
【题目】某校化学兴趣小组同学将一只烧杯罩在2支高低不同的燃着的蜡烛上(如图1所示),发现总是高的蜡烛先熄灭。请你同他们一起进行探究。
(提出问题)为什么高的蜡烛先熄灭?
(猜想假设)猜想1:高的蜡烛先灭是因为上部的二氧化碳浓度高;猜想2:高的蜡烛先灭是因为上部的氧气先被消耗。
(实验探究1)为了验证猜想1是否成立,冰冰同学进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
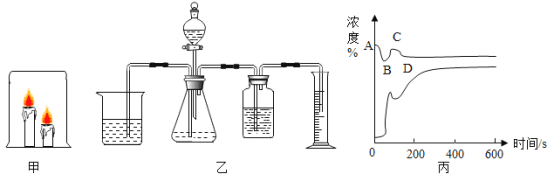
将浸有澄清石灰水的滤纸条分别放在烧杯的顶部和底部,在滤纸条上滴加酚酞,变色后,用烧杯罩住点燃的高低蜡烛,观察高低滤纸条褪色顺序(实验装置如图甲所示) | _________ | 猜想1成立,该实验涉及的反应的化学方程式为_________ |
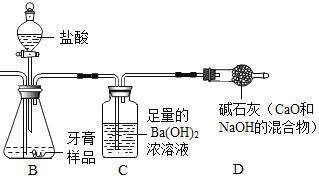
明明对冰冰的结论表示怀疑,他用图乙装置收集一瓶80%二氧化碳和20%氧气的混合气体,然后将燃着的蜡烛伸入收集的混合气体瓶中,发现_________,从而证明冰冰的结论不正确。
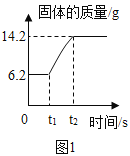
(实验探究2)明明为了验证猜想2,他利用手持技术实验,用O2、CO2传感器在烧杯顶部测量杯内两支蜡烛从点燃到全部熄灭后,杯内O2和CO2的浓度变化,如图丙所示,图中______(填“上方”或“下方”)的曲线表示CO2浓度的变化。反应后剩余氧气浓度为15.65%,二氧化碳浓度为1.898%,氧气浓度明显下降,二氧化碳浓度却增大不多。
(实验结论)___________。
(反思评价)根据图2中上面一条曲线(装置内氧气浓度)变化分析,在________(填“A”“B”“C”或“D”)点时蜡烛全部熄灭:请解释曲线AB段、BC段、CD段变化的原因。
AB段:_____________;BC段:___________;CD段:_________
【题目】化学与生活密切相关。
Ⅰ.每100克巧克力中营养成分的含量如下表。
蛋白质/g | 脂肪/g | 糖类/g | 矿物质/mg | 维生素B/mg | 维生素C/mg | 总能量/千焦 | ||
5 | 32 | 51 | 钙 | 铁 | 磷 | 0.2 | _____ | 2142 |
50 | 4 | 120 | ||||||
(1)表中缺少人体必需的六大营养素中的____,2142千焦能量全部来自糖类吗?____(填“是”或“不是”)。
(2)摄入_____(填元素符号,下同)元素不足会导致骨骼疏松,易得佝偻病。钙、铁、磷元素中属于人体必需微量元素的是____。
Ⅱ.水是生命之源。请回答下列问题:
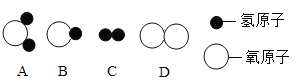
(1)构成水的粒子可表示为________(填序号)。
(2)下列物质加入水中能形成乳浊液的是________。(填序号)
A 粉笔灰 B 蔗糖 C 植物油
(3)硬水是指含有较多________、________(填微粒符号)的水。生活中,常用________鉴别硬水和软水。
(4)如图为电解水的实验装置图,下列说法正确的是________。
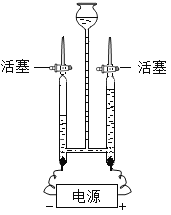
A 根据该实验所得产物,说明水分子可分
B 在水中加入少量稀硫酸以增强水的导电性
C 该实验中所得氢气和氧气的质量比约为2:1
D 与正极相连的玻璃管内得到的气体能使带火星的木条复燃
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的简要工业流程如下:
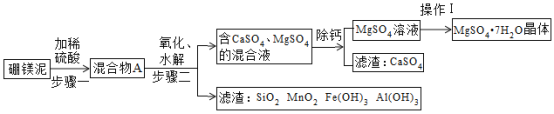
根据题意回答下列问题:
(1)实验中需要用98%的浓硫酸(p=1.84g/mL)来配制一定浓度的稀硫酸。下列所给的仪器中,属于配制过程中必须使用的有_____________(填写选项字母)。
A 普通漏斗
B 蒸发皿
C 量筒
D 烧杯
E 玻璃棒
F 药匙
(2)混合物A中,除了Mg2+、Ca2+、Mn2+、Fe2+,还含有的金属阳离子有______________(填离子符号)。
(3)经过步骤二的过程,化合价发生变化的两种金属元素是______________(填元素符号)。
(4)已知MgSO4、CaSO4溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
①从表中数据可以总结出CaSO4溶解度随温度的变化趋势是___________________。
②“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据分析,“除钙”适宜的温度是______________(填“较低温度”或“较高温度”)。
(5)“操作I”是将滤液继续蒸发浓缩,冷却结晶,________________,便得到MgSO4·7H2O。