题目内容
【题目】稀土,是一组典型的金属元素。其之所以异常珍贵,不仅是因为储量少,不可再生,分离提纯和加工难度较大,更因其广泛应用于农业、工业、军事等行业;稀土是新材料制造的重要依托和关系尖端国防技术开发的关键性资源,被称之为万能之土,也素有“工业维生素”之称。稀士元素铈在元素周期表中信息如图所示。
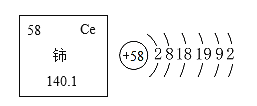
(1)铈(shi)的原子序数为_______________________。
(2)加入Ce2O3的玻璃属于________________材料;
(3)由于特殊的原子结构,铈的化学性质较为_______________________。
【答案】58 复合 活泼
【解析】
(1)根据元素周期表中的一格可知,左上角的数字为58,铈元素的原子序数为58。
(2)加入Ce2O3的玻璃,即玻璃中加入了Ce2O3,玻璃属于无机非金属材料,加入了Ce2O3,加入Ce2O3的玻璃属于复合材料。
(3)其原子核外有6个电子层,最外层电子数是2,在化学反应中易失去2个电子而形成阳离子,由于特殊的原子结构,铈的化学性质较为活泼。

【题目】化学与生活密切相关。
Ⅰ.每100克巧克力中营养成分的含量如下表。
蛋白质/g | 脂肪/g | 糖类/g | 矿物质/mg | 维生素B/mg | 维生素C/mg | 总能量/千焦 | ||
5 | 32 | 51 | 钙 | 铁 | 磷 | 0.2 | _____ | 2142 |
50 | 4 | 120 | ||||||
(1)表中缺少人体必需的六大营养素中的____,2142千焦能量全部来自糖类吗?____(填“是”或“不是”)。
(2)摄入_____(填元素符号,下同)元素不足会导致骨骼疏松,易得佝偻病。钙、铁、磷元素中属于人体必需微量元素的是____。
Ⅱ.水是生命之源。请回答下列问题:
(1)构成水的粒子可表示为________(填序号)。
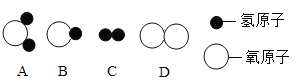
(2)下列物质加入水中能形成乳浊液的是________。(填序号)
A 粉笔灰 B 蔗糖 C 植物油
(3)硬水是指含有较多________、________(填微粒符号)的水。生活中,常用________鉴别硬水和软水。
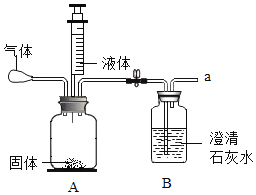
(4)如图为电解水的实验装置图,下列说法正确的是________。
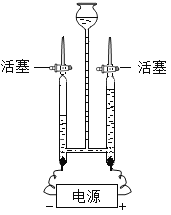
A 根据该实验所得产物,说明水分子可分
B 在水中加入少量稀硫酸以增强水的导电性
C 该实验中所得氢气和氧气的质量比约为2:1
D 与正极相连的玻璃管内得到的气体能使带火星的木条复燃
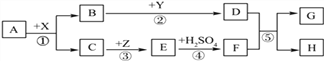
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的简要工业流程如下:
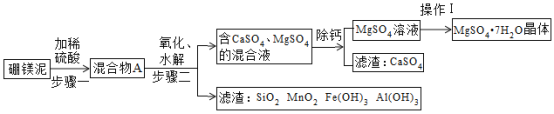
根据题意回答下列问题:
(1)实验中需要用98%的浓硫酸(p=1.84g/mL)来配制一定浓度的稀硫酸。下列所给的仪器中,属于配制过程中必须使用的有_____________(填写选项字母)。
A 普通漏斗
B 蒸发皿
C 量筒
D 烧杯
E 玻璃棒
F 药匙
(2)混合物A中,除了Mg2+、Ca2+、Mn2+、Fe2+,还含有的金属阳离子有______________(填离子符号)。
(3)经过步骤二的过程,化合价发生变化的两种金属元素是______________(填元素符号)。
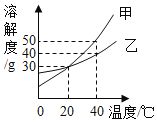
(4)已知MgSO4、CaSO4溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
①从表中数据可以总结出CaSO4溶解度随温度的变化趋势是___________________。
②“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据分析,“除钙”适宜的温度是______________(填“较低温度”或“较高温度”)。
(5)“操作I”是将滤液继续蒸发浓缩,冷却结晶,________________,便得到MgSO4·7H2O。