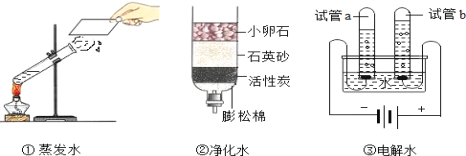
题目内容
【题目】精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
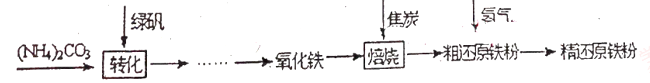
(物质制备)利用绿矾制备精还原铁粉的工艺流程如下:
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为:
Fe3C+2H2![]() 3Fe+CH4 FexOy+yH2
3Fe+CH4 FexOy+yH2![]() xFe+yH2O
xFe+yH2O
(1)已知焙烧中发生的主要反应是CO夺取氧化铁中的氧元素,得到单质铁与另一种碳的氧化物,请写出该反应的化学方程式_____________。
(2)焙烧中加焦炭的作用除了可以作燃料提供反应所需高温外,还能________。
(含量测定)甲同学为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知:3CH4+4Fe2O3![]() 3CO2+6H2O+8Fe,浓硫酸有吸水性,可以吸收混合气体中的水热气,碱石灰不仅 能吸收水而且能吸收CO2。(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
3CO2+6H2O+8Fe,浓硫酸有吸水性,可以吸收混合气体中的水热气,碱石灰不仅 能吸收水而且能吸收CO2。(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
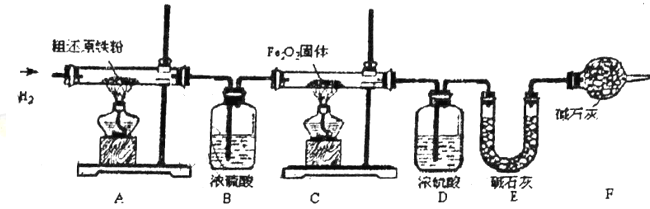
(3)主要实验步驟如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;③点燃C处酒精灯;④点燃A处酒精灯;⑤分别熄灭A、C处酒精灯;⑥再次缓缓通入H2;⑦再次称量必要装置的质量。
步骤②的目的是___________,步骤⑥的目的是__________。
(4)反应后C装置中的现象是_____________。
(5)若缺少装置F,则所测碳元素的质量分数将_____________(“偏大”、“偏小”或“不变”)。
【答案】3CO+ Fe2O3 ![]() 2Fe + 3CO2 提供CO 除去装置内的氧气,防止发生爆炸 防止铁氧化 固体由红变黑 偏大
2Fe + 3CO2 提供CO 除去装置内的氧气,防止发生爆炸 防止铁氧化 固体由红变黑 偏大
【解析】
(1)根据“焙烧中发生的主要反应是CO夺取氧化铁中的氧元素,得到单质铁与另一种碳的氧化物”和质量守恒定律可知,CO与氧化铁在高温条件下反应生成铁和二氧化碳,该反应的化学方程式为:3CO+ Fe2O3 ![]() 2Fe + 3CO2;
2Fe + 3CO2;
(2)焙烧中加焦炭的作用除了可以作燃料提供反应所需高温外,还能提供CO;
(3)氢气具有可燃性,在加热或点燃时易发生爆炸,步骤②的目的是除去装置内的氧气,防止发生爆炸,铁在高温下易与空气中的氧气反应,步骤⑤后反应生成的铁温度较高,步骤⑥再次缓缓通入H2的目的是防止铁氧化,导致实验的失败;
(4)C装置中的反应是3CH4+4Fe2O3![]() 3CO2+6H2O+8Fe,反应后C装置中的现象是固体由红变黑;
3CO2+6H2O+8Fe,反应后C装置中的现象是固体由红变黑;
(5)装置F可以吸收空气中的二氧化碳与水蒸气,否则装置F会吸收空气中的二氧化碳和水造成质量偏大,误认为生成的二氧化碳多,造成测定结果偏大。

【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实验 | A | B | C | D |
装置 |
|
|
|
|
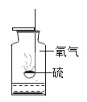
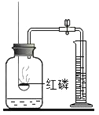
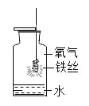
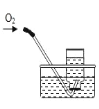
解释 | 集气瓶中的水:吸 收放出的热量 | 量筒中的水:通过水 的体积变化得出 O2 的体积 | 集气瓶中的水:冷 却溅落熔融物,防 止集气瓶炸裂 | 集气瓶中的水:水 先将集气瓶内的空 气排净 |
A. A B. B C. C D. D