题目内容
【题目】质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)下图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子:
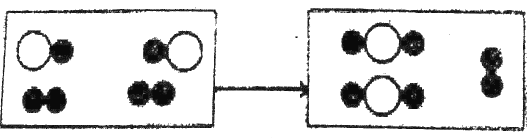
由“○●”聚集成的物质_________(填“可能”或“不可能”)是氧化物,参加反应的两种反应物的分子个数为________,此反应的基本反应类型为_________。
(2)硫化氢气体可以在氧气中燃烧生成黄色固体单质和水,反应的化学方程式是________; 镁条能在二氧化碳中燃烧,生成一种白色固体氧化物和一种黑色固体,请写出该反应的化学方程式_______。
【答案】可能 2:1 化合反应 2H2S+O2![]() 2S+2H2O 2Mg+CO2
2S+2H2O 2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
(1)根据图示可以看出反应前后存在没有参与反应的分子,所以该图示可以转化为如图的情况: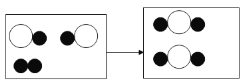 。氧化物中含有两种元素且其中一种是氧元素,
。氧化物中含有两种元素且其中一种是氧元素,![]() 中如果存在氧原子则该物质可能是氧化物;由图示可知参加反应的两种反应物分子的个数比为2:1,该反应的反应物是两种生成物是一种,所以该反应是化合反应;
中如果存在氧原子则该物质可能是氧化物;由图示可知参加反应的两种反应物分子的个数比为2:1,该反应的反应物是两种生成物是一种,所以该反应是化合反应;
(2)硫化氢气体可以在氧气中燃烧生成黄色固体单质和水,反应的化学方程式是2H2S+O2![]() 2S+2H2O;镁条能在二氧化碳中燃烧,生成一种白色固体氧化物和一种黑色固体,根据质量守恒定律以及氧化镁是白色固体,碳是黑色固体,该反应生成物是氧化镁和碳,化学方程式2Mg+CO2
2S+2H2O;镁条能在二氧化碳中燃烧,生成一种白色固体氧化物和一种黑色固体,根据质量守恒定律以及氧化镁是白色固体,碳是黑色固体,该反应生成物是氧化镁和碳,化学方程式2Mg+CO2![]() 2MgO+C。
2MgO+C。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目