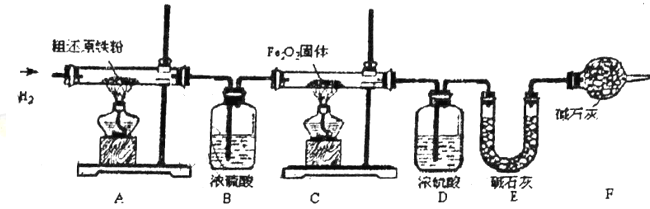
题目内容
【题目】金属是生产生活中重要的材料,也是初中化学学习的重要内容。
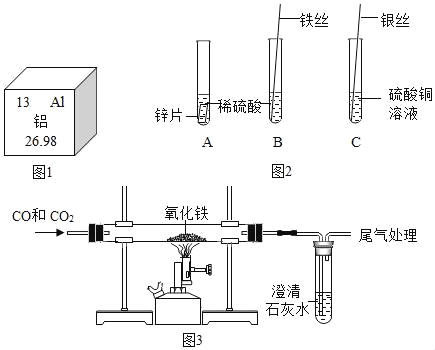
(1)如图1是铝在元素周期表中的信息,其相对原子质量是_____;比铝元素少一个周期多一个族的元素是_____。
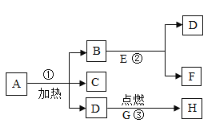
(2)为了验证锌、铁、铜、银的金属活动性顺序,某同学进行如图2所示的实验。
①该同学能否达到实验目的______(填“能”或“不能”)?理由是____。
②自选四种试剂,另外设计实验方案,证明以上四种金属的活动性顺序,写出所用试剂即可_______________。
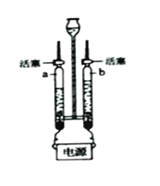
(3)实验室用如图3装置进行模拟炼铁的实验。
①玻璃管中的实验现象是_____;
②试管中反应的化学方程式为_____;
③要证明实验中有二氧化碳生成,还需将装置如何改进_____?
(4)金属钛生产的主要方法是在保护气中加热镁和四氯化钛的混合物使其发生置换反应。若要生产12t金属钛,理论上需要四氯化钛的质量为多少_____?
【答案】26.98 C 不能 该实验能说明锌比铁活泼,铜比银活泼,无法判断是铁和铜的活动顺序 硫酸锌、铁、硫酸铜、银(或锌、硝酸亚铁溶液、铜、硝酸银溶液;合理答案即可) 红棕色粉末逐渐变黑 CO2+Ca(OH)2═CaCO3↓+H2O 气体在通入氧化铁前,应除去混合气体中的二氧化碳(或在玻璃管前加一个装有氢氧化钠溶液的洗瓶) 47.5 t
【解析】
(1)根据铝在元素周期表中的信息,汉字下面的数字表示相对原子质量,铝相对原子质量是 26.98;在元素周期表中,左上角的数字表示原子序数,铝的原子序数为13,铝原子核外有3个电子层,最外层电子数为3,在元素周期表中,周期数等于电子层数,族序数等于最外层电子数,比铝元素少一个周期多一个族的元素是两个电子层且最外层电子为4,所以是 C(碳)。
(2)①该实验中锌与稀硫酸反应速度比铁快,能说明锌比铁活泼,银不能将硫酸铜中的铜置换出来,说明铜比银活泼,但是无法判断是铁和铜的活动顺序,所以不能达到实验目的;
②金属的活动性顺序中锌>铁>铜>银,取适量硫酸锌溶液于试管中,插入铁丝,铁丝无变化,证明锌的金属活泼性比铁强,取适量硫酸铜溶液于试管中,插入铁丝,铁丝表面有红色固体出现,证明铁的金属活泼性比铜强,取适量硫酸铜溶液于试管中,插入银丝,银丝无变化,证明铜的金属活泼性比银强。自选四种试剂,另外设计实验方案,证明以上四种金属的活动性顺序,可选用的试剂是硫酸锌、铁、硫酸铜、银(或锌、硝酸亚铁溶液、铜、硝酸银溶液;合理答案即可);
(3)①玻璃管中是氧化铁转化为铁,所以对应的实验现象是红棕色粉末逐渐变黑;
②试管中是二氧化碳和氢氧化钙反应生成碳酸钙和水,对应的化学方程式为 CO2+Ca(OH)2═CaCO3↓+H2O;
③要证明实验中有二氧化碳生成,需要将通入的气体中的二氧化碳除去,然后才能通过试管中氢氧化钙变浑浊得出生成物有二氧化碳,所以体在通入氧化铁前,应除去混合气体中的二氧化碳(或在玻璃管前加一个装有氢氧化钠溶液的洗瓶);
(4)设理论上需要四氯化钛的质量为x。
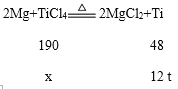
![]() x=47.5 t
x=47.5 t
答:理论上需要四氯化钛的质量为47.5 t。

【题目】化学课外活动小组为测定“石头纸”中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表:(假设纸张其他成分既不溶于水,也不与水反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成 气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
(1)表中X的值为 ;
(2)求样品中碳酸钙的质量分数;
【题目】某研究小组同学发现,超市里有一种神奇的污渍爆炸盐(如图1)能除去各种顽固污渍,溶于水,有许多气泡产生.该小组同学探究该气体的成分.

(猜想与假设)
小华说:该气体可能是CO2、O2、CO、H2、N2.
小明说:不可能含有N2,因为______.
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,CO有毒性.H2_____.
该小组同学认为:该气体可能含有CO2、O2中的一种或两种.
(进行实验)
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(得出结论)
(1)由实验①可知,该气体中肯定含有______,由实验②______(填“能”或“不能”)确定该气体中不含氧气,理由是______.
(2)为了进一步确定是否产生了O2,老师利用氧气传感器测得O2的浓度变化如图2所示,证明该气体中_______(填“有”或“没有”)氧气.