题目内容
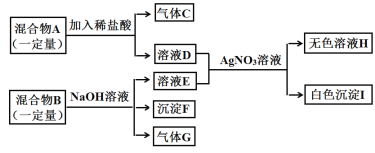
【题目】某小组在探究铁、铜、镁、银的金属活动性顺序时,做了如下三个实验(所用金属的形状与大小和稀盐酸的用量均相同):
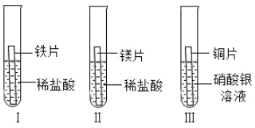
①通过实验 I 和 II 可比较出镁和铁的金属活动性强弱。他们依据的实验现象是_____。
②通过观察到实验III 的现象可得出的结论是_____,该反应的化学方程式为_____。
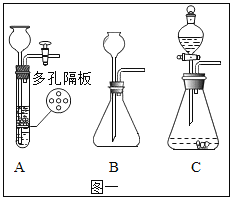
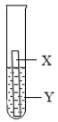
③上述三个实验不能够得出四种金属的活动性顺序。探究小组在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。他们实验所用金属 X、Y 溶液分别是_____。
④小组同学又将一定量的锌粉加入含有 AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中,充分反应后过滤,得到了一定量的固体和无色的滤液。则固体中一定含有_____,滤液中一定含有的溶质是_____(填化学式)。
【答案】实验Ⅱ比实验Ⅰ反应剧烈 铜比银活泼 Cu+2AgNO3→2Ag+Cu(NO3)2 Fe/CuSO4(或Cu/H2SO4) Ag、Cu Zn(NO3)2、Mg(NO3)2
【解析】
①实验中可观察到实验 II 比实验 I反应剧烈,不同的金属与同样的酸反应,反应越剧烈,说明金属的活动性越强,故填实验Ⅱ比实验Ⅰ反应剧。
②将铜片放到硝酸银溶液中,可观察到铜片上出现银白色固体,说明铜的活动性比银强,能将银从其盐溶液中置换出来,故填铜比银活泼;
铜与硝酸银反应生成银和硝酸铜,故反应的化学方程式写为:Cu+2AgNO3=2Ag+Cu(NO3)2。
③上述三个实验不能够验证铁和铜活动性的强弱,要验证铁和铜活动性的强弱,可选择的方法是验证铜能不能与酸反应,或铁能否置换铜盐溶液中的铜即可,所以选择的药品是Fe/CuSO4或Cu/H2SO4,故填Fe/CuSO4(或Cu/H2SO4)。
④铜盐溶液都呈现蓝色,由题文充分反应后过滤,得到了一定量的固体和无色的滤液可知,AgNO3、Cu(NO3)2均完全反应,被还原为金属单质,所以固体中一定含有Ag、Cu,故填Ag、Cu;
锌的活动性比镁弱,不能与Mg(NO3)2反应,锌与AgNO3、Cu(NO3)2反应后均生成Zn(NO3)2,所以滤液中一定含有的溶质是Zn(NO3)2、Mg(NO3)2,故填Zn(NO3)2、Mg(NO3)2。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】在学习“燃烧与灭火”的课堂上,老师做了一个有趣的实验:将一根铜丝绕成线圈,罩在蜡烛火焰上(如图所示),观察到火焰立即熄灭。
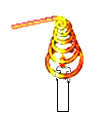
(1)探究一:蜡烛熄灭的原因。
猜想与假设:a.铜线圈隔离了可燃物;b.铜线圈隔绝了空气;c.铜线圈吸热,降温至蜡烛着火点以下。
讨论与交流:经观察分析同学们否定了猜想a和b,理由是___。
设计并进行如下实验:
实验操作 | 实验现象 | 结论 |
将铜圈加热后___ | ___ | 猜想c正确 |
(2)探究二:经过多次上述实验大家发现铜丝表面变黑黑色物质是什么呢?
猜想与假设:①炭黑;②___;③炭黑和氧化铜。
(查阅资料):氧化铜可与稀硫酸反应生成硫酸铜(溶液显蓝色)和水,炭黑不与稀硫酸反应。
讨论交流:铜丝表面产生发炭黑或氧化铜的原因是___(写一条即可)。
实验操作 | 实验现象 | 结论 |
取少许黑色固体至试管中,___ | ___ | 猜想③正确 |
【题目】1kg不同燃料燃烧产生CO2和SO2的质量如表所示。
燃料 | 燃烧产物质量/g | |
CO2 | SO2 | |
汽油 | 2900 | 5.0 |
天然气 | 2500 | 0.1 |
煤 | 2500 | 11.0 |
①其中较清洁的燃料是______,使用______做燃料时最易形成酸雨。
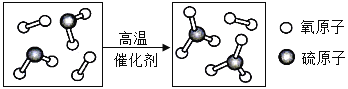
②酸雨形成过程中某一步反应的微观示意图如下图所示。则该反应的化学方程式为______。