题目内容
【题目】黄铜(铜锌合金)是重要的金属材料,常用来制造机械零件,仪表和日用品。为测定黄铜材料中锌的含量,化学研究小组进行了实验:称取15.0g 此黄铜材料,向其中逐渐加入稀盐酸,测定产生气体的质量和加入稀盐酸的质量,并根据实验情况绘制了产生气体质量与加入稀盐酸的关系图。请你仔细分析此关系图,并进行计算:
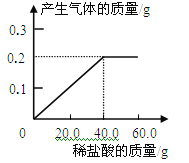
(1)15.0g黄铜材料中含锌_________g。
(2)稀盐酸中溶质的质量分数(写出计算过程,计算结果精确到0.1%)
【答案】(1)6.5g(2)18.3%
【解析】
试题分析:通过图像可知锌与稀盐酸反应生成的氢气的质量为0.2g,利用化学方程式,根据反应的质量比即可计算出锌的质量和稀盐酸中溶质的质量。
设黄铜中锌的质量为x,稀盐酸中溶质的质量为y,
Zn + 2HCl == ZnCl2 + H2↑
65 73 2
X y 0.2g
65/2 =x/0.2g 73/2 =y/0.2g
X=6.5g y=7.3g
反应的图像可知,锌与稀盐酸恰好完全反应时消耗的稀盐酸的质量为40g,故
稀盐酸中溶质的质量分数=7.3g/40g ×100%=18.3%
答:略

【题目】小明家新楼房刚修好。准备用石灰浆刷墙。石灰浆是用生石灰与水充分搅拌形成糊状物。工人师傅将石灰浆糊在墙上推平整。开始墙面很软,慢慢地会自然变干变硬。有一天小明回家,发现刚糊好的墙面掉下一块白色固体。准备通过实验来研究该固体的成分,请你参与。
(猜想)固体可能是A:生石灰,B:_________ ,C:___________。D:熟石灰和石灰石。
小明经过分析认为A是不可能的。请你用方程式解释___________。
(实验)小明取少量固体研细,加入一定量蒸馏水搅拌,澄清。
操作方法 | 现象 | 结论 |
取上层清液少许,滴入1-2滴无色酚酞试液 | 无现象 | 猜想____ 不正确 |
小明另取少量固体于试管,注入___________发现有气泡。故猜想__________成立。
(反思)产生气泡的原因(方程式)______________。