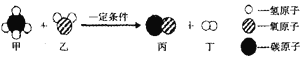
题目内容
【题目】如图所示,在6支试管中分别低价2滴紫色石蕊溶液。(资料:KCl溶液、CaCl2溶液均显中性)
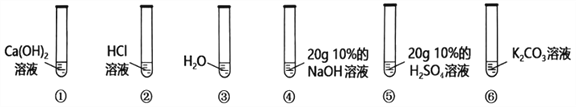
(1)作为对照试验的是试管__________(选填①~⑥编号)。
(2)试管②、⑤溶液变为红色,其原因是溶液中溶质都含有________元素。
(3)试管⑥中溶液变为蓝色,说明碳酸钾溶液显________(选填“酸性”、“中性”或“碱性”)。碳酸钾属于________(填物质类别),可做________肥使用,取该溶液灼烧,透过蓝色钴玻璃火焰呈________色。
(4)将试管⑤倒入试管④中,写出该反应的化学方程式________________________________。
充分反应后溶液呈现________________。
A.红色 B.紫色 C.蓝色
(5)实验后将试管①②⑥中的废液倒入大烧杯中,最终得到红色溶液,则大烧杯的废液中除了石蕊外,一定还含有________________________________。
【答案】 ③ H 碱性 盐 钾 紫 H2SO4 + 2NaOH →Na2SO4 + 2H2O C CaCl2、KCl、HCl
【解析】(1)水是几种溶液的溶剂,故用水做对比实验;
(2)盐酸和硫酸的水溶液中都能电离出氢离子,故都能使石蕊溶液变为红色;
(3)石蕊遇碱变蓝,故说明碳酸钾溶液显碱性;碳酸钾是由金属离子和酸根离子构成的,故是盐;碳酸钾中含有有钾元素,故可以做氮肥;钾的焰色反应呈紫色;
(4)氢氧化钠与稀硫酸反应生成硫酸钠和水,反应方程式为H2SO4 + 2NaOH →Na2SO4 + 2H2O;80份质量的氢氧化钠和98份质量的硫酸恰好完全反应,故题中氢氧化钠有剩余,故溶液变为蓝色,故选C;
(5)将氢氧化钙、稀盐酸、碳酸钾倒入同一废液烧杯中后,溶液显红色,说明盐酸有剩余,故氢氧化钙和碳酸钾已经完全反应,故溶液中的溶质有盐酸、氯化钾、氯化钙;

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】硅钢是制变压器、充电器的核心材料,其主要成分是Fe和Si。某同学用硅钢样品进行如下实验:取6.60 g硅钢样品,将60.00 g稀硫酸分6次加入样品中(其中稀硫酸与硅及其他杂质不反应)。实验测得相关数据如下:
稀硫酸的用量 | 剩余固体的质量 |
第1次加入10.00 g | W g |
第2次加入10.00 g | 4.36 g |
第3次加入10.00 g | 3.24 g |
第4次加入10.00 g | 2.12 g |
第5次加入10.00 g | 1.00 g |
第6次加入10.00 g | 1.00 g |
(1)根据表中数据,稀硫酸加入到第________次,铁恰好反应完全。
(2)表中W=________g。
(3)计算该稀硫酸溶质的质量分数是__________(写出计算过程)。
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下稀盐酸和氢氧化钙发生的中和反应实验探究。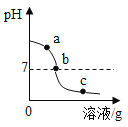
【演示实验】由图可知该实验操作是将______________滴加到另一种溶液中。该反应的化学方程式是___________________________;
【查阅资料】CaCl2溶液显中性, CaCl2+Na2CO3 =CaCO3↓+2NaCl
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2
猜想Ⅱ:有____________________
猜想Ⅲ:有CaC12和Ca(OH)2
猜想Ⅳ:有CaCl2、HC1和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是____________________________;
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊试液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | _______________ | ______________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想Ⅲ是正确的。
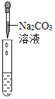
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_______________________________;
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑________________。