题目内容
【题目】硅钢是制变压器、充电器的核心材料,其主要成分是Fe和Si。某同学用硅钢样品进行如下实验:取6.60 g硅钢样品,将60.00 g稀硫酸分6次加入样品中(其中稀硫酸与硅及其他杂质不反应)。实验测得相关数据如下:
稀硫酸的用量 | 剩余固体的质量 |
第1次加入10.00 g | W g |
第2次加入10.00 g | 4.36 g |
第3次加入10.00 g | 3.24 g |
第4次加入10.00 g | 2.12 g |
第5次加入10.00 g | 1.00 g |
第6次加入10.00 g | 1.00 g |
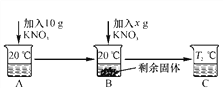
(1)根据表中数据,稀硫酸加入到第________次,铁恰好反应完全。
(2)表中W=________g。
(3)计算该稀硫酸溶质的质量分数是__________(写出计算过程)。
【答案】 5 5.48 19.6%。
【解析】对于数据处理题,应先找出数据之间的规律,然后发现规律被破坏,进而分析原因,在硅钢(主要成份是Fe和Si)中加入稀硫酸,其中铁会与稀硫酸反应,Si不会与稀硫酸反应,故加入稀硫酸后,铁会与稀硫酸反应,使得剩余固体质量减少,根据表中数据可看出,每10g硫酸就消耗4.36g﹣3.24g=1.12g铁,但当第六次加入稀硫酸,剩余固体质量不变,此时规律被打破,分析可知,铁被完全消耗完了,此时剩下的1.00g固体全是S i。
解:(1)根据表格中的数据,通过对比分析与10克稀硫酸恰好完全反应的铁的质量,每10g硫酸就消耗4.36g﹣3.24g=1.12g铁,所以第五次加入稀硫酸时样品中的铁已经完全反应;
(2)由表格数据,通过对比分析可知,表格中的数据,通过对比分析与10g稀硫酸恰好完全反应的铁的质量4.36g﹣3.24g=1.12g,因此w=6.60g﹣1.12g=5.48g;
(3)设10g稀硫酸中所含H2SO4的质量为x
Fe+H2SO4=FeSO4+H2↑
56 98
1.12g x
![]()
x=1.96g
稀硫酸的溶质质量分数为=![]() =19.6%
=19.6%

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】某校同学开展了如下“溶液酸碱性的检验”的实验活动:
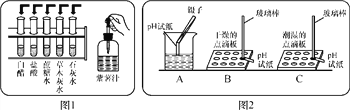
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
加入紫薯汁 后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
①图1中存放紫薯汁的仪器名称:________;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是________;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于________(填“酸性”“中性”或“碱性”)溶液,白醋pH________(填“>”“<”或“=”)7;
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是________(填“A”“B”或“C”,下同),可能导致被测溶液pH数值发生改变的错误操作是________。
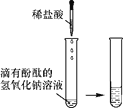
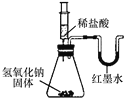
【题目】某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象。
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量。
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告。
同学 | 实验操作 | 现象 | 结论 |
甲 |
| 溶液由红色变成________ | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为__________ |
乙 |
| U形玻璃管中________边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
丙 | 用________测定氢氧化钠溶液的pH;向其中滴加足量的稀盐酸后,再测定溶液的pH | 最后溶液的pH________(填“≥7”“≤7”或“不变”) | 氢氧化钠与盐酸发生了化学反应 |
【评价反思】你认为实验设计方案不合理的同学是________,理由是______________________________。