题目内容
用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
(1)该实验是将(选填“稀盐酸”或“氢氧化钠溶液”)滴 加到另一种溶液中,该反应的基本类型是 。
(2)当加入溶液的质量a为20 g时,求所得溶液中溶质的质量。
(1)氢氧化钠溶液复分解反应 (2)2.9克
解析试题分析:(1)从图示信息溶液的pH由小于7到等于7最后再到大于7可知,该反应是把氢氧化钠溶液滴加到稀盐酸中,该反应是酸碱中和反应,属于基本反应类型——复分解反应。
(2)从图示信息可知,当加入溶液的质量为a克时,氢氧化钠溶液与稀盐酸恰好完全反应,此时所得溶液中溶质的质量是氯化钠。根据氢氧化钠溶液的质量及其质量分数可以计算出纯氢氧化钠的质量,然后结合氢氧化钠与稀盐酸反应的化学方程式便可求出溶质氯化钠的质量。
解:设所得溶质质量为x,则
NaOH + HCl =" NaCl+" H2O
40 58.5
20g×10%x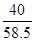 =
= 
x=2.93 g
答:当加入溶液的质量a为20 g时,所得溶液中溶质的质量为2.93 g。
考点:酸碱中和反应,根据化学方程式的计算。

练习册系列答案
相关题目
铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 70 | 70 | 70 | 70 |
| 剩余固体质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
(1)合金中铜、镁的质量比.
(2)所加稀硫酸的溶质的质量分数.(写出计算过程)
 2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数.
2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数. O2↑+2H2O.请计算:
O2↑+2H2O.请计算:
