��Ŀ����
ͭþ�Ͻ���������ĵ����ԣ��������ɻ����ߵȵ�����ϣ����ⶨ�Ͻ����ɣ�����Ԫ�غ��Բ��ƣ�����������ʵ�飺ȡͭ�Ͻ�20g�����ձ�����280gϡ�����4�μ����ձ��У���ַ�Ӧ���ʣ������������¼���£�����㣺
| ���� | 1 | 2 | 3 | 4 |
| ����ϡ��������/g | 70 | 70 | 70 | 70 |
| ʣ���������/g | 18.2 | 16.4 | 14.6 | 13.2 |
��1���Ͻ���ͭ��þ�������ȣ�
��2������ϡ��������ʵ�������������д��������̣�
��1��33��17 ��2��10.5%
���������������1��ʣ����������Ϊͭ������������ͭ������Ϊ13.2g������þ������=20g��13.2g=6.8g���Ͻ���ͭ��þ��������=13.2��6.8=33��17��
��2�������������ݿ�֪����70gϡ������ȫ��Ӧ����þ������Ϊ1.8g��
����1.8g����þ��Ӧ��ϡ��������ʵ�����Ϊx��
Mg+H2SO4�TMgSO4+H2��
24 98
1.8g x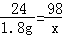
x=7.35g
����ϡ��������ʵ���������=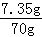 ��100%=10.5%
��100%=10.5%
������ϡ��������ʵ���������10.5%��
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ��㣻�й��������������ļ��㣮
�����������Ѷ�һ�㣬���ۺ���ǿ������Ϣ���������ʽ�����˽����Ļ�ѧ���ʡ������غ㶨�ɵ�Ӧ�õȣ���ɴ�������������е�֪ʶ���У�

ijͬѧΪ�˲ⶨʵ�������������Ʒ�Ĵ��ȣ�ȡ2��5g����Ʒ��0��5g�������̻�ϣ����ȸû����t1ʱ������ʲ��μӷ�Ӧ������ȴ������ʣ������������ظ����ϲ��������γƵü���t2��t3��t4ʱ���ʣ��������������¼�������±���
| ����ʱ�� | t1 | t2 | t3 | t4 |
| ʣ�����������g�� | 2��12 | 2��08 | 2��04 | 2��04 |
��1������t3ʱ���������Ƿ��Ѿ���ȫ��Ӧ�� �����ǻ��
��2������ȫ��Ӧ��������������� ��
��3�������Ʒ������ص�����������
ij�о�С����������ᾧ����Ʒ�ֽ���ﲢ�ⶨ�������������������ʲ����뷴Ӧ�������ᾧ�壨H2C2O4?2H2O�����������ʼ�����
��1�����ȷֽ���ᾧ�������˵�װ���� ����ͼ1��ĸ��ţ���
��2��ͼ2����֤�ȷֽ�����к�CO��CO2��װ��
������a��b�����Ʒֱ��� �� ��
��֤������CO2�������� ��֤������CO�������� ��D�з�Ӧ�Ļ�ѧ����ʽ�� ��
��װ��A�������� �����ҵ������� ��
��3��Ϊ�ⶨ��Ʒ�в��ᾧ�����������������������·�����
| �۵� | �е� | ���ȶ��� | ��Ӧ |
| 101��C��102��C | 150��C��160��C���� | 100.1��Cʧȥ�ᾧˮ��175��C�ֽ��CO2��CO��H2O | ��Ca��OH��2��Ӧ������ɫ������CaC2O4�� |
�ڳ�ȡ8.75g���ᾧ����Ʒ����50.00g��Һ��ȡ10.00g��Һ��������ϡ���ᣬȻ��μ�25.00g3.16%KMnO4��Һ��ǡ�÷�Ӧ��ȫ��
����֪��2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O����KMnO4��Һ�� ɫ��25.00g3.16%KMnO4��Һ��KMnO4������ g���������Ʒ�е�����������[д��������̣�M2��H2C2O4��=90��M2��H2C2O4?2H2O��=126��M2��KMnO4��=158]��


