题目内容
我国首台使用二甲醚为燃料的城市客车有效地解决了公交车冒黑烟的问题.
(1)已知二甲醚的化学式为C2H6O,二甲醚的相对分子质量是 ,其中碳、氢元素的质量比为 。
(2)二甲醚在空气中完全燃烧生成二氧化碳和水,请计算完全燃烧92g二甲醚需要氧气多少克?
解:(1)46; 4:1; (2)192g
解析试题分析:(1)化合物的相对分子质量就等于各原子的相对原子质量的总和,各元素的质量比就等于各原子的相对原子质量之和的比;
(2)根据质量守恒定律,已知二甲醚的质量求出需要氧气的质量。
解:(1)二甲醚的相对分子质量为:12×2+1×6+16=46;碳、氢元素的质量比=(12×2):(1×6)=4:1;
(2)设完全燃烧92g二甲醚需要氧气的质量为x
C2H6O+3O2 2CO2+3H2O
2CO2+3H2O
46 96
92g x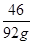 =
=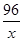
解得x=192g
答:完全燃烧92g二甲醚需要氧气的质量为192g
考点:考查相对分子质量的概念及其计算;元素质量比的计算;根据化学反应方程式的计算

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案某同学为了测定实验室中氯酸钾样品的纯度,取2.5g该样品与0.5g二氧化锰混合.加热该混合物t1时间后(杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表:
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 2.12 | 2.08 | 2.04 | 2.04 |
(1)加热t3时间后氯酸钾是否已经完全反应? (填是或否).
(2)求完全反应后产生氧气的质量 .
(3)求该样品中氯酸钾的质量分数.
某研究小组欲检验草酸晶体样品分解产物并测定器质量分数(假设杂质不参与反应).草酸晶体(H2C2O4?2H2O)的理化性质见表.
(1)加热分解草酸晶体最适宜的装置是 (填图1字母序号).
(2)图2是验证热分解产物中含CO,CO2的装置
①仪器a和b的名称分别是 和 .
②证明存在CO2的现象是 ,证明存在CO的现象是 ,D中反应的化学方程式是 .
③装置A的作用是 ,气囊的作用是 .
(3)为测定样品中草酸晶体的质量分数,设计两种如下方案.
| 熔点 | 沸点 | 热稳定性 | 与碱反应 |
| 101°C~102°C | 150°C~160°C升华 | 100.1°C失去结晶水,175°C分解成CO2,CO,H2O | 与Ca(OH)2反应产生白色沉淀(CaC2O4) |
②称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,恰好反应完全.
(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)则KMnO4溶液显 色,25.00g3.16%KMnO4溶液中KMnO4的质量 g.请计算样品中的质量分数.[写出计算过程,M2(H2C2O4)=90,M2(H2C2O4?2H2O)=126,M2(KMnO4)=158].