题目内容
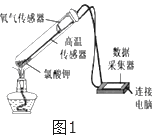
【题目】在老师的指导下,小华和小明利用如图1所示装置对氯酸钾制氧气进行了深入的探究学习。
资料:
①氯酸钾的熔点约为356℃,二氧化锰的分解温度约为535℃。用酒精灯给物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
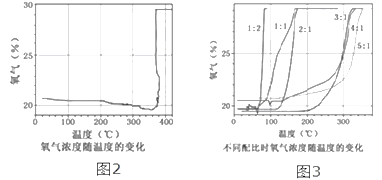
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下:
请回答问题:
(1)二氧化锰在535℃以上分解生成四氧化三锰和氧气,其反应方程式为_____________。
(2)分析图2,氧气的浓度随温度升高逐渐减小,在380℃突然增大的原因是氯酸钾分解温度______(填“高于”、“等于”或“低于”)其熔点。
(3)分析图3,氯酸钾分解温度随物质配比变化的规律是_____________。
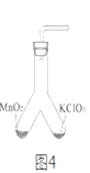
(4)为证实二氧化锰的催化作用,小华利用如图4装置进行如表所示的实验:
步骤 | 实验操作 | 实验现象 |
I | 检查气密性 | |
II | 分别在“Y”形管两侧支管中加入少量的二氧化锰和氯酸钾塞紧橡皮塞 | |
III | 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导气管口。 | 加热左侧支管,可观察到 加热右侧支管,可观察到 |
IV | 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 | 加热时间短于步骤III,木条很快复燃。 |
请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到_______,加热左侧试管的目的是_______。加热右侧支管,可观察到_______
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是_________。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的__________和__________不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的化学方程式为__________。
【答案】3MnO2 ![]() Mn3O4+O2↑ 高于 质量比越小,分解温度越低(或“质量比越大,分解温度越高”) 带火星的木条不复燃 证明在酒精灯加热下MnO2不分解 KClO3融化为液态,带火星的木条复燃 将“Y”形管向右倾斜 质量 化学性质 2KClO3
Mn3O4+O2↑ 高于 质量比越小,分解温度越低(或“质量比越大,分解温度越高”) 带火星的木条不复燃 证明在酒精灯加热下MnO2不分解 KClO3融化为液态,带火星的木条复燃 将“Y”形管向右倾斜 质量 化学性质 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
【解析】
(1)二氧化锰在535℃以上分解生成四氧化三锰和氧气,反应方程式故填3MnO2![]() Mn3O4+O2↑;
Mn3O4+O2↑;
(2)由图可知氯酸钾分解的温度在380℃,高于氯酸钾的熔点,故填高于;
(3)通过分析图3中氯酸钾的分解数据可知,KClO3分解温度随物质配比变化的规律是质量比越大,分解温度越高,故填质量比越小,分解温度越低(或“质量比越大,分解温度越高”);
(4)
①酒精灯提供的温度是400℃,二氧化锰分解的温度是535℃以上,酒精灯加热左侧支管,无氧气生成,带火星木条不复燃,故填带火星的木条不复燃;加热左侧试管的目的故填证明在酒精灯加热下MnO2不分解;由图2可知氯酸钾分解的温度是380℃,氯酸钾的熔点是356℃,酒精灯加热右侧支管,氯酸钾先融化后分解生成氧气,带火星木条复燃,故填KClO3融化为液态,带火星的木条复燃;
②将“Y”形管向右倾斜,二氧化锰混入右侧支管有余热的氯酸钾中,故填将“Y”形管向右倾斜;
③在化学反应里能改变其他物质的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质叫做催化剂,还需证明在此反应中二氧化锰的质量和化学性质在反应前后都不变,故填质量;故填化学性质;在二氧化锰的催化作用下,加热氯酸钾分解为氯化钾和氧气,方程式故填2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。