题目内容
【题目】黄铜矿(主要成分CuFeS2)冶炼纯铜的主要工艺流程(流程中未涉及的杂质发生的反应不考虑)如下

(1)步骤Ⅰ生成的硫化亚铜(Cu2S)中,铜元素的化合价为 __________。
(2)步骤Ⅱ中发生的主要反应如下:
①2FeS+302![]() 2FeO+2SO2,该反应中生成的气体溶于雨水,形成 ______,对环境产生了较大影响。
2FeO+2SO2,该反应中生成的气体溶于雨水,形成 ______,对环境产生了较大影响。
②硫化亚铜(Cu2S)与氧气在高温下反应生成氧化亚铜(Cu2O)和二氧化硫,该反应的化学方程式为 _______________________________。
③硫化亚铜与氧化亚铜反应:Cu2S+2Cu2O![]() 6Cu+SO2
6Cu+SO2![]()
步骤Ⅱ在开始反应后,只需吹入空气就可继续进行,不需另用燃料加热,说明吹炼氧化时的反应大多为 ______________(填“放热”或“吸热”)反应。
(3)步骤Ⅲ中的反应体现了CO的什么性质?______________。
【答案】+1 酸雨 2Cu2S+ 3O2![]() 2Cu2O+2SO2 放热 还原性
2Cu2O+2SO2 放热 还原性
【解析】
(1)化合物中各元素化合价的代数和为零,硫化亚铜(Cu2S)中,硫元素的化合价是-2,所以铜元素的化合价为+1。
(2)①形成酸雨的主要原因是空气中二氧化硫、二氧化氮气体含量较高。②根据题意,反应的化学方程式为:2Cu2S+ 3O2![]() 2Cu2O+2SO2 ③在开始反应后,只需吹入空气就可继续进行,不需另用燃料加热,说明吹炼氧化时的反应大多为放热反应。
2Cu2O+2SO2 ③在开始反应后,只需吹入空气就可继续进行,不需另用燃料加热,说明吹炼氧化时的反应大多为放热反应。
(3)步骤Ⅲ中Cu2O转变为Cu,Cu2O是氧化剂,所以CO是还原剂,还原剂具有还原性。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】为研究化学反应前后,反应物与生成物之间的质量关系,三位同学分别做了这样三个实验。

实验一:称量镁条的质量,在空气中点燃,待反应结束、冷却后,再称量生成白色固体的质量。
实验二:如图甲,将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后将两种溶液混合 (有蓝色氢氧化铜沉淀和硫酸钠生成),过一会儿再称量。
实验三:如图乙,将装有稀盐酸的小试管放入装有大理石的烧杯中,称量,然后将稀盐酸与大理石混合,过一会儿再称量。实验数据见表:
编号 | 实验一 | 实验二 | 实验三 |
变化前 | 4.8g | 118.4g | 112.6g |
变化后 | 8.0g | 118.4g | 111.0g |
(1)表中数据看,这三个实验过程中,发生化学反应的前后物质质量(填“减小“增大”或“不变”):实验一______,实验二_____,实验三_____。
⑵这三个实验中,实验___(选填:“一”、“二”或“三”)正确地反映了反应物与生成物之间的质量关系。
⑶从不能正确反映反应物和生成物之间质量关系的实验中,选择其中一个说明实验设计中的不当之处___,请写出该实验所发生反应的化学方程式_____。
⑷由此可得出,在选用有气体参加或生成的化学反应来验证质量守恒定律时,必须在_____(填“密闭”或“开放”)的体系中进行。
【题目】实验室部分装置如下图所示,请回答:
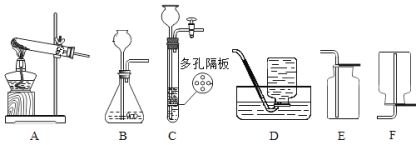
(提示:装置C的多孔隔板,可以放置颗粒大小比孔径大的固体)
(1)下表是初中几种常见气体的实验室制法,请你在横线上的空白处填上答案。
反应物 | 制取气体 | 发生装置(填字母) | 收集装置(填字母) |
大理石和稀盐酸 | CO2 | B或____ | _______ |
锌粒和稀硫酸 | H2 | B | D或____ |
高锰酸钾 | _______ | A | E或____ |
(2)大理石和稀盐酸反应制二氧化碳的化学方程式为:___________。
(3)若使用图1装置收集氧气,气体应从_____________(填“a”或“b”)端通入。若通过连接图1和图2装置来测量氧气的体积,应将图2装置的c端与图1装置的_____________(填“a”或“b”)端相连。
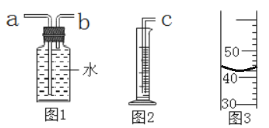
一段时间后量筒内的凹液面如图3所示,则集得氧气的体积是_______mL。
【题目】在老师的指导下,小华和小明利用如图1所示装置对氯酸钾制氧气进行了深入的探究学习。
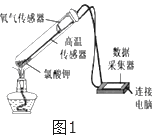
资料:
①氯酸钾的熔点约为356℃,二氧化锰的分解温度约为535℃。用酒精灯给物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下:
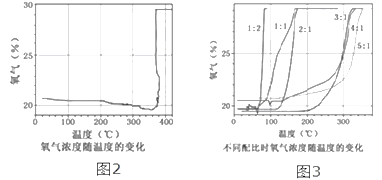
请回答问题:
(1)二氧化锰在535℃以上分解生成四氧化三锰和氧气,其反应方程式为_____________。
(2)分析图2,氧气的浓度随温度升高逐渐减小,在380℃突然增大的原因是氯酸钾分解温度______(填“高于”、“等于”或“低于”)其熔点。
(3)分析图3,氯酸钾分解温度随物质配比变化的规律是_____________。
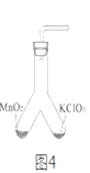
(4)为证实二氧化锰的催化作用,小华利用如图4装置进行如表所示的实验:
步骤 | 实验操作 | 实验现象 |
I | 检查气密性 | |
II | 分别在“Y”形管两侧支管中加入少量的二氧化锰和氯酸钾塞紧橡皮塞 | |
III | 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导气管口。 | 加热左侧支管,可观察到 加热右侧支管,可观察到 |
IV | 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 | 加热时间短于步骤III,木条很快复燃。 |
请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到_______,加热左侧试管的目的是_______。加热右侧支管,可观察到_______
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是_________。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的__________和__________不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的化学方程式为__________。