题目内容
【题目】原水(未经处理的水)中含有泥沙悬浮物和细菌等杂质,可用次氯酸杀死细菌。氯气溶解于水时,可生成盐酸和次氯酸。某水厂生产自来水的净化步骤如图1所示:
(1)A步骤中加明矾的作用为_____。
(2)该厂生产的自来水是_____。(填“纯净物”或“混合物”)
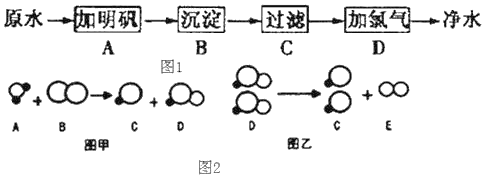
(3)能消毒杀菌的步骤为_____(填标号)。自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用如图2表示:(![]() 表示氧原子;
表示氧原子;![]() 表示氢原子;
表示氢原子;![]() 表示氯原子)
表示氯原子)
①图乙所示反应的基本反应类型为_____反应;
②上述物质中,属于氧化物的有_____(填化学式);
③根据图甲微观示意图得出的结论中,正确的是_____。
A.反应前后各元素的化合价都不变
B.化学反应的实质就是原子的重新组合
C.反应前后分子种类不变
D.该反应中C和D的分子个数比1:1
(4)日常生活中使用硬水会带来许多麻烦,家庭生活中常用来降低水硬度的方法_____。
【答案】形成胶状物,吸附杂质,加速沉降 混合物 D 分解 H2O BD 煮沸
【解析】
(1)A步中加明矾的作用是利用明矾溶于水后生成的胶状物对悬浮物有吸附作用,使杂质沉降而达到净水的目的;故填:形成胶状物,吸附杂质,加速沉降;
(2)该厂生产的自来水中含有多种物质,属于混合物;故填:混合物;
(3)氯气能消毒杀菌,能消毒杀菌的步骤为D;故填:D;
①乙图的反应物是次氯酸,生成物是氯化氢和氧气,反应的方程式为:2HClO=2HCl+O2↑,该反应属于分解反应;故填:分解;
②反应中的水是由两种元素组成的化合物,且含有氧元素,属于氧化物;故填:H2O;
③A.反应中氯元素的化合价由0价转化为﹣1价和+1价,此选项错误;B.化学反应的实质就是原子的重新组合,此选项正确;C.反应前后分子种类发生了改变,此选项错误;D.该反应的方程式为Cl2+H2O=HCl+HClO,即C和D的分子个数比1:1,此选项正确。故选BD;
(4)家庭生活中常用煮沸来降低水硬度;故填:煮沸。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
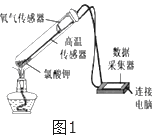
三点一测快乐周计划系列答案【题目】在老师的指导下,小华和小明利用如图1所示装置对氯酸钾制氧气进行了深入的探究学习。
资料:
①氯酸钾的熔点约为356℃,二氧化锰的分解温度约为535℃。用酒精灯给物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
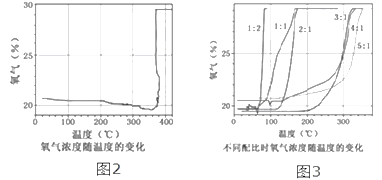
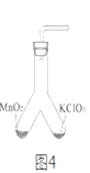
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下:
请回答问题:
(1)二氧化锰在535℃以上分解生成四氧化三锰和氧气,其反应方程式为_____________。
(2)分析图2,氧气的浓度随温度升高逐渐减小,在380℃突然增大的原因是氯酸钾分解温度______(填“高于”、“等于”或“低于”)其熔点。
(3)分析图3,氯酸钾分解温度随物质配比变化的规律是_____________。
(4)为证实二氧化锰的催化作用,小华利用如图4装置进行如表所示的实验:
步骤 | 实验操作 | 实验现象 |
I | 检查气密性 | |
II | 分别在“Y”形管两侧支管中加入少量的二氧化锰和氯酸钾塞紧橡皮塞 | |
III | 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导气管口。 | 加热左侧支管,可观察到 加热右侧支管,可观察到 |
IV | 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 | 加热时间短于步骤III,木条很快复燃。 |
请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到_______,加热左侧试管的目的是_______。加热右侧支管,可观察到_______
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是_________。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的__________和__________不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的化学方程式为__________。
