题目内容
【题目】如图为实验室常用的实验装置.回答问题:从下列提供的仪器中进行选择,可以组装多套制取气体的装置,请回答有关问题.
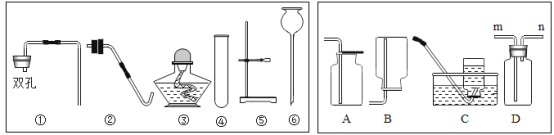
(1)标号仪器的名称:⑥________.
(2)实验室用加热高锰酸钾制氧气,发生装置应从①-⑥中选择____________仪器组合(填编号)。
(3)若要收集一瓶干燥的氧气,则收集装置可以选_______(填字母A-C);若D装置装满水用来收集氧气,气体应从_______(填m或n)进。
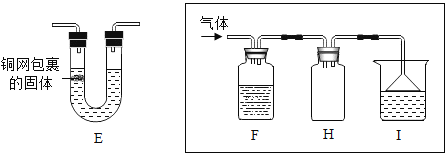
(4)使用①④⑥组合还可以制备CO2气体,反应方程式为_____________________________小明对制备CO2的发生装置进行如图E的改造,该装置的优点是:_______________________
(5)某同学在实验室制备SO2气体,现要收集一瓶干燥的SO2气体,则F瓶中的液体是___,且I瓶装的是NaOH的浓溶液,请你推测I装置的作用:_________________________ 。并在F和H装置把导管补充完整(请在答题卡上画)。_____
【答案】长颈漏斗 ②③④⑤ A n CaCO3+2HCl═CaCl2+H2O+CO2↑ 可以控制反应的开始和停止 浓硫酸 吸收SO2,防止空气污染 
【解析】
(1)通过分析题中所指仪器的作用可知,⑥是长颈漏斗;
(2)实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,所以实验室用加热高锰酸钾制氧气,发生装置应从①-⑥中选择②③④⑤仪器组合;
(3)排空气法收集的气体干燥,氧气密度比空气大,所以要收集一瓶干燥的氧气,则收集装置可以选A,氧气密度比水小,不易溶于水,所以D装置装满水用来收集氧气,气体应从n进;
(4)使用①④⑥组合还可以制备CO2气体,,不加热,固液反应,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,E装置通过装置内压强的改变可以实现固体和液体的分离,具体实验操作是关闭开关,反应生成的气体使装置内压强增大,液体试剂与固体试剂分离,反应停止,打开开关,气体导出压强减小,固液接触反应开始,所以对制备CO2的发生装置进行如图E的改造,该装置的优点是:可以控制反应的开始和停止;
(5)浓硫酸具有吸水性,可以用来干燥酸性气体二氧化硫。二氧化硫的密度比空气大,二氧化硫有毒,会污染空气,二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,所以要收集一瓶干燥的SO2气体,则F瓶中的液体是浓硫酸,且I瓶装的是NaOH的浓溶液,I装置的作用:吸收SO2,防止空气污染,洗气应该长进短出,所以F和H装置把导管如图:

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案【题目】从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中。将100g稀盐酸分5次加入烧杯中。测得烧杯中物质的质量变化如下表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
(1)第5次加入稀盐酸时,烧杯中溶质是
(2)求铝片中铝单质的质量分数。
(3)在下图中画出生成H2的质量与所加稀盐酸的质量关系。
(4)已被氧化的铝占未被氧化前铝片的质量分数是 。
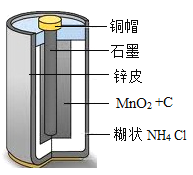
【题目】某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。查阅资料可知 Mg、Mg3N2能发生如下反应:
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题:
(1)连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是_____(填装置序号)。D装置中发生反应的化学方程式为_____。
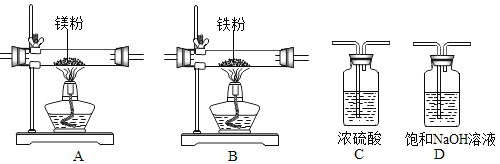
(2)通气后,应先点燃_____(填“A”或“B”)装置的酒精灯,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_____。
(3)设计一个实验,验证产物是氮化镁:
实验操作和实验现象 | 实验结论 |
_____ | 产物是氮化镁 |
(4)思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却远大于Mg3N2的质量,请给出合理的解释_____。