题目内容
【题目】盐城濒临黄海,海盐文化全国知名.某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究:
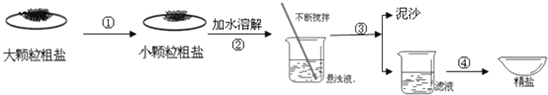
(1)操作①中必须用到的一种仪器是 (填序号)
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作③的名称是 ,操作④中用到玻璃棒,作用为 .
(3)用提纯得到的“精盐”配制100g 7.5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有 (填序号)
①氯化钠固体不纯
②称量时精盐与砝码放反了
③量取水时俯视读数
④装瓶时,有少量溶液洒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:

①白色沉淀的化学式为 .
②在得到的滤液中加入足量的稀盐酸的目的是 .
③若实验过程中不考虑损耗,最终到的NaCl固体的质量将 (填“大于”、“小于”或“等于”)原精盐中NaCl的质量.
【答案】(1)A (2)过滤 防止局部稳定过高,液体飞溅 (3)①②
(4)Mg(OH)2 除去过滤的氢氧根离子 大于
【解析】
试题分析:(1)粗盐的由大变小,采用的是研磨的方法,故需要的仪器是研钵,选A;
(2)通过操作3得到了固体和液体,故采用的方法是过滤;操作④是蒸发,蒸发要用到玻璃棒,作用是搅拌,目的是防止局部稳定过高,液体飞溅;
(3)溶质的质量分数等于溶质的质量除以溶液的质量,溶液的质量=溶质的质量+溶剂的质量。先溶质的质量分数偏小,可能是溶质的质量偏小或溶剂的质量偏大,故选①②;
(4)溶液中加入氢氧化钠,氢氧化钠会与氯化镁反应生成氢氧化镁沉淀和氯化钠,故白色沉淀是氢氧化镁;由于加入的氢氧化钠是过量的,即氯化钠溶液中含有氢氧化钠,故要把氢氧化钠除去,加入稀盐酸的目的就是除去过滤的氢氧化钠;由于除杂质的过程中生成了氯化钠,故最终到的NaCl固体的质量将大于原精盐中NaCl的质量。