题目内容
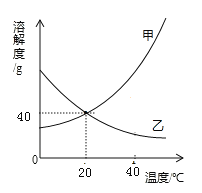
【题目】(8分)为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如图所示的pH曲线,请回答:
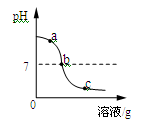
(1)由图可知该实验操作是将 滴加到另一种溶液中;
(2)该反应的化学方程式为 ;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现 的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | 该样品为b处溶液。 | |
该样品为c处溶液,并推知溶液中的阳离子有 。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑 。
【答案】(1)稀盐酸 (2) Ca(OH)2+2HCl==CaCl2+2H2O
(3)【探究过程】①溶液由无色变成红色
②
实验步骤 | 实验现象 | 结论 |
只产生白色沉淀(产生白色沉淀也可) | ||
先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知溶液中的阳离子有Ca2+ 、H+ |
【反思评价】 反应物是否过量
【解析】
试题分析:由图可知该实验操作是将稀盐酸滴加到氢氧化钙中,因为开始时溶液的PH值大于7,该反应的化学方程式为Ca(OH)2+2HCl==CaCl2+2H2O;该样品是a处溶液属于碱性因此溶液由无色变成红色;为进一步确定b或c处溶液
实验步骤 | 实验现象 | 结论 |
只产生白色沉淀(产生白色沉淀也可) | ||
先产生气泡,后产生白色沉淀 | Ca2+ 、H+ |
从该实验看出:探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑反应物是否过量。

【题目】人类的第二杀手﹣﹣心脑血管疾病,这类疾病患者大多数属于酸性体质,应经常食用碱性食品.根据下表的信息,这类患者应经常食用的食物为( )
食物 | 葡萄 | 牛奶 | 豆制品 | 苹果 |
pH | 3.5~4.5 | 6.3~7.3 | 7.4~7.9 | 2.9~3.3 |
A.牛奶 B.葡萄 C.苹果 D.豆制品