题目内容
【题目】为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验.
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光.
【实验二】取粗细、长短相同的锌丝、铜丝、镍丝均与50mL稀盐酸反应,实验记录如下:
锌 | 铜 | 镍 | 铜 | |
稀盐酸的质量分数 | 3% | 3% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
【实验三】金属锌、铜和稀盐酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光.
(1)实验一的现象说明三种金属都具有 性.
(2)镍与稀盐酸反应生成氯化镍(NiCl2)和氢气,反应的化学方程式是 ,铜不能与稀盐酸发生化学反应的原因是 ,在金属活动性顺序中排在氢的后面
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是 .
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变.下列关于实验三分析正确的是 (填选项).
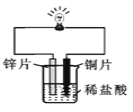
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能.
【答案】(1)导电;
(2)Ni+2HCl═NiCl2+H2↑;铜不活泼,在金属活动性顺序中排在氢的后面;
(3)把粗细、长短相同的锌丝、镍丝放入15%的50mL稀盐酸中,观察放出气泡的快慢;
(4)C
【解析】
试题分析:
(1)实验一的现象说明三种金属都具有导电性;
(2)镍与稀盐酸反应生成氯化镍(NiCl2)和氢气,反应的化学方程式为:Ni+2HCl═NiCl2+H2↑;
铜不能与稀盐酸发生化学反应的原因是:铜不活泼,在金属活动性顺序中排在氢的后面;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论:把粗细、长短相同的锌丝、镍丝放入15%的50mL稀盐酸中,观察放出气泡的快慢,放出气泡快并且多的金属活动性强;
(4)铜的金属活动性比锌弱,A错误;铜不能和稀盐酸反应,B错误;该装置将化学能转化为电能,C正确,故选C。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】人类的第二杀手﹣﹣心脑血管疾病,这类疾病患者大多数属于酸性体质,应经常食用碱性食品.根据下表的信息,这类患者应经常食用的食物为( )
食物 | 葡萄 | 牛奶 | 豆制品 | 苹果 |
pH | 3.5~4.5 | 6.3~7.3 | 7.4~7.9 | 2.9~3.3 |
A.牛奶 B.葡萄 C.苹果 D.豆制品