��Ŀ����
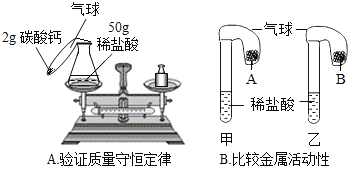
����Ŀ���ܽ��������еij�������A��B��C�������ʵ��ܽ�������ͼ1��ʾ��
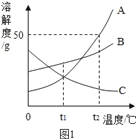
��1�����Ҫ������ͬŨ�ȵ�A��C������Һ����Ҫ���¶ȿ�����__��ʱ��
��2��t2��ʱ����60gA����100gˮ���ܵõ�A�ı�����Һ���������ʺ���Һ��������Ϊ__����������ȣ���
��3������һ����B�ı�����Һ��Ϊ��������Һʱ������˵������ȷ����__��
A ������������һ����С
B �ܼ��������ܲ���
C ��Һ����һ������
��4��ͼ2�Ƕ�20��һ��������B��Һ���к���������ʵ����̣�
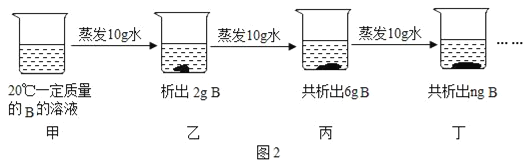
������ǰԭ��Һ��__����������������������������Һ��
��n����ֵ��__g���ס��ҡ��������ĸ��ձ��У���ҺŨ����ȵ���__��
���𰸡�t1 1��3 AC ������ 10 �ҡ�������
��������
��1��ͨ�������ܽ�����߿�֪����t1��ʱ��A��C���ʵ��ܽ����ȣ�����Ҫ������ͬŨ�ȵ�A��C������Һ����Ҫ���¶ȿ�����t1��ʱ�����t1��
��2��t2��ʱ��A���ʵ��ܽ����50g������60gA����100gˮ���ܵõ�A�ı�����Һ���������ʺ���Һ��������Ϊ50g��150g=1��3�����1:3��
��3������һ����B�ı�����Һ��Ϊ��������Һʱ��
A�������¶�ʱ�����������������䣬��A���������⣻
B�������¶�ʱ���ܼ��������ܲ��䣬��B��ȷ�����������⣻
C�������¶�ʱ����Һ�������䣬��C���������⡣
��ѡ��AC��
��4���ٵ�һ������10gˮ������2g���壬�ڶ�������10gˮ������4g���壬��������ǰԭ��Һ�Dz�������Һ����������͡�
�ڵ���������10gˮҲ������4g���壬����n����ֵ��10g���ס��ҡ��������ĸ��ձ��У�����Һ�Dz�������Һ���ҡ��������DZ�����Һ�������¶Ȳ��䣬��ҺŨ����ȵ����ҡ������������10���ҡ���������

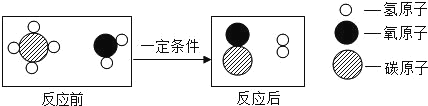
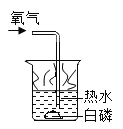
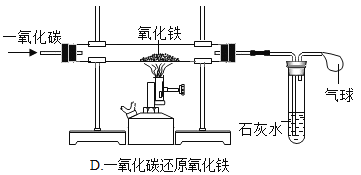
����Ŀ������кͷ�Ӧ�dz��г����ķ�Ӧ��
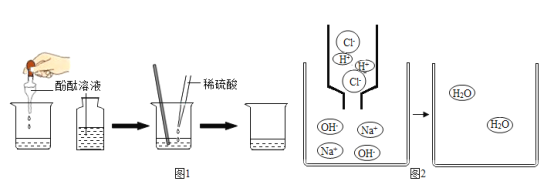
��1��д��������Ӧ�Ļ�ѧ����ʽ_____��
��2��������������Һ�еμ����ᣬǡ����ȫ��Ӧʱ����ʾ��ͼ��ͼ2������ͼ�л�����Ӧ����Һ�д��ڵ�����_____��
��3���������������Ҳ���Խ�������ʵ�飬ȡ��ͬŨ�ȣ���λ����ں�����ķ�������ͬ�������������ᣬ̽����NaOH��Һ����������Ӧ�������������
ʵ���� | ������� | NaOH��Һ����� | ��Ӧ�¶�/�� | ��Һ��ɫʱ�������/mL |
�� | ���� | 10mL | 25 | 2 |
�� | ���� | 10mL | 25 | 4 |
�� | ���� | 10mL | 45 | 5 |
����������ʵ���У�����ͬʱ����Ҫ���Ƶ�һ�������ǣ�_____����ͬ�����£������������Һ���٣�ԭ������ͬŨ����ͬ���ʱ��������Һ���и����_____���û�ѧ���������ȽϢں͢۷��֣������������䣬�¶�����ʱ��Ҫʹ��Һ��ɫ��Ҫ�����������ᣬԭ���������_____��
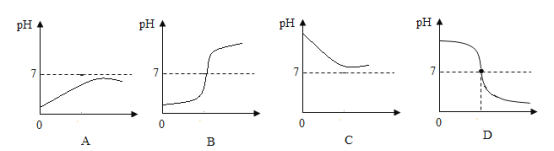
��4��С��ͬѧ�����һ���Լ������˳���������ձ���ʢ10mLϡ���ᣬ���뼸�η�̪��Һ���õι���μ�������������Һ�������Ͻ��裬������Һ��죬���������ܹ���ʾ��һ��������ҺpHֵ�仯������____��