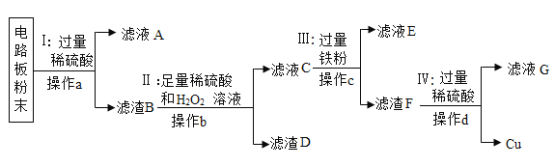
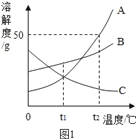
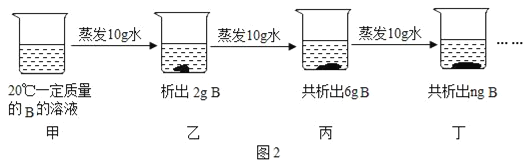
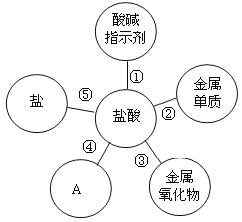
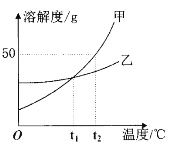
��Ŀ����
����Ŀ������ijУ��ѧ���ũ���������ʵ�������Ļ�ḻ��ʣ�����������ɫ��ѧ��Ϊ������������»��������ʵ���ҷ�ҺͰ���ռ��˺��д���FeSO4��CuSO4�ķ�ˮ��Ϊ��ֹ��ˮֱ���ŷŵ���ˮ������ؽ�����Ⱦ���˷ѣ���������»����������������ͭ��ʵ�鷽����
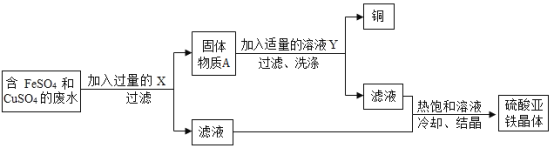
��ش��������⣺
��1������ʵ������ж�β��ù��ˣ��ò����õ��IJ����������ձ���__�Ͳ�������
��2����������X��__��������ˮ������Ӧ�Ļ�ѧ����ʽΪ__����ҺY��__������A�к��е�������__��
��3����С���ͬѧ���ռ���һЩ��������������ͭ�Ļ�Ϸ�Һ��ͬѧ�������м���һ����п�ۣ���Ӧֹͣ����ˣ���Һ��Ϊ��ɫ�����й��ж���ȷ����__
A ������һ��������û��ͭ��п
B ������һ��������п��������ͭ
C ������һ��������п������ͭ��������
D ������һ��������п������ͭ����������������
���𰸡�©�� Fe Fe+CuSO4=FeSO4+Cu ϡ���� Cu��Fe D
��������
��Һ�л����������������ͭ������ʵ�鷽������ȷ����ԭ�����������������ʵ��ķ�Ӧԭ��������������������ᾧ�IJ���������Ŀ���ǻ��ͭ���ʺ�����������������Ҫ��ͭ����ת��Ϊͭ���ʣ�����Һ����Ҫ�����������������������µ����ʣ����Լ�����ܹ���ͭ����ת��Ϊͭ���ʵ�ֻ���ǵ����������ڼ�������ǹ����ģ��������ϡ�����Ŀ���dz�ȥͭ�е�����
��1�������ǽ������Թ������Һ�з�������IJ�������װ��������Ҫ�������У�����̨��©������ֽ���ձ��Ͳ����������©����
��2��Ϊ���շ�Һ�е�Cu2+���������ͭǰ��Ľ��������û�����Ҫ�õ���Ϊ����FeSO4����Һ��ֻ�����Һ�м������������������ͭ�����û���Ӧ����������ֻ��������������������������Һ���ֻ����������ʡ��������������Ϊ�˽�ͭ����ȫ���û�������ͭ��������棬�����ᷴӦ������������ǰ�棬���ᷴӦ�����Ϊ��ȥ����ͭ��������۲��ҵõ�FeSO4��Һ���ѽ�����������������ϡ���Ტ���˼��ɡ����Fe��Fe+CuSO4=FeSO4+Cu��ϡ���Cu��Fe��
��3���������ֽ��������ǿ������˳��п��ͭ����������п�ۼ��뵽����ͭ���������Ļ����Һ��ʱ�������ȱ��û�������������ȫ�û���ͭ���ܱ��û�������һ������п�ۣ�������ȫת��������Ҳ����ֻ�û������ֵ�������Һ����ɫ��˵����Һ�к�������ͭ��п����û���û���ͭ���п����û�������ͭ����ѡD��

����Ŀ���Ҵ��׳ƾƾ���������ҽ��������Ҳ����ȼ�ϣ�����ȫȼ�յĻ�ѧ����ʽ�ɱ�ʾΪ��C2H6O+3O2![]() 2CO2+3H2O
2CO2+3H2O
��1�����ݻ�ѧ����ʽ���㣺46g�Ҵ���ȫȼ�������Ķ��ٿ�������
��2���Ҵ�����ȫȼ�ջ����CO��ijʵ���÷�Ӧǰ������ʵ��������±����ش���������
���� | �Ҵ� | ���� | CO2 | ˮ | CO |
��Ӧǰ������g�� | 4.6 | 8.8 | 0 | 0 | 0 |
��Ӧ��������g�� | 0 | 0 | 6.6 | 5.4 | a |
�ٱ���a��ֵΪ����
������ɸ÷�Ӧ�Ļ�ѧ����ʽ��4C2H6O+11O2![]() ����CO2+����H2O+����CO��
����CO2+����H2O+����CO��