题目内容
将30g铁铜混合物与100g稀硫酸恰好完全反应,剩余物的总质量为129g,求:(1)混合物中铁的质量是多少?(2)稀硫酸溶液中溶质的质量分数是多少?(3)反应后所得溶液中溶质的质量分数又是多少?(相对原子质量Fe-56,S-32,O-16, H-1)
28g 49% 59.8%
解析试题分析:(1)根据质量守恒定律得产生氢气的质量为(30g+100g)- 129g = 1g
解:设混合物中铁的质量是xg, 100g稀硫酸中硫酸的质量为yg,生成硫酸亚铁的质量为zg
Fe + H2SO4 = FeSO4 + H2 ↑
56 98 152 2
x y z 1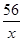 =
=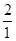
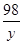 =
=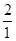
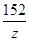 =
=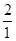
x = 28g y = 49g z = 76g
(2)稀硫酸溶液中溶质的质量分数= 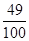 x 100% = 49%
x 100% = 49%
(3)反应后所得溶液中溶质FeSO4质量为76g,
反应后所得溶液的质量=(30g+100g)-1g-2g=127g
反应后所得溶液中溶质的质量分数=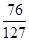 ×100% = 59.8%
×100% = 59.8%
考点:质量守恒定律、利用化学方程式计算。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
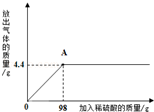
某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,将四份不同质量的样品加入到四份稀盐酸中,进行实验,结果如下:
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
(1)上表中m的数值是__________________;
(2)试计算这种石灰石矿中碳酸钙的质量分数。
(3)第三次反应后所得溶液的溶质质量分数是多少?