题目内容
【题目】氧气能跟很多物质反应。根据如图所示实验,并阅读资料,回答下列问题。
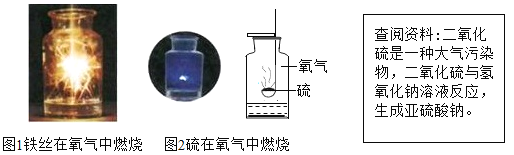
Ⅰ小明对图1铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析回答:
物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时的现象 | 剧烈燃烧,发出耀眼白光,无火星 | 剧烈燃烧极少火星 | 剧烈燃烧少量火星 | 未填 |
①表中“未填”部分的内容应为__________________;
②铁丝在氧气燃烧的文字表达式是______________________。
③通过以上探究,你认为铁丝燃烧产生火星四射现象的原因可能是__________。
Ⅱ图2中反应的文字表达式为______________,集气瓶中加入的液体可能是____________。
【答案】剧烈燃烧,火星四射 铁+氧气![]() 四氧化三铁 铁丝中含碳量≥0.6% 硫+氧气
四氧化三铁 铁丝中含碳量≥0.6% 硫+氧气![]() 二氧化硫 水(或氢氧化钠溶液)
二氧化硫 水(或氢氧化钠溶液)
【解析】
Ⅰ.①表中“未填”部分的内容应为剧烈燃烧,火星四射;
②铁丝在氧气燃烧的文字表达式是:铁+氧气![]() 四氧化三铁;
四氧化三铁;
③通过以上探究可知,铁丝燃烧产生火星四射现象的原因可能是铁丝中含碳量≥0.6%;
Ⅱ.图2中的反应现象为:硫剧烈的燃烧,发出明亮的蓝紫色火焰;
反应的文字表达式为:硫+氧气![]() 二氧化硫;
二氧化硫;
集气瓶中加入的液体可能是水(或氢氧化钠溶液),其主要目的是吸收反应生成的二氧化硫,防止污染空气。

 举一反三单元同步过关卷系列答案
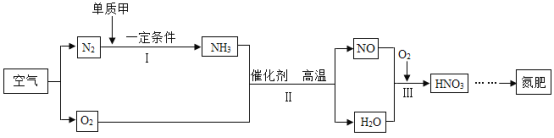
举一反三单元同步过关卷系列答案【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?
(设计并完成实验)
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将xg氯酸钾与1.0g氧化铜均匀混合加热
(实验现象分析)Ⅲ中x的值应为_____,将实验Ⅰ和Ⅲ比较可证明_____,将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后_____和_____都不变。
(结论1)氧化铜也能作氯酸钾分解的催化剂,请写出实验Ⅲ中的化学反应文字表达式_____。
(继续探究)小组同学完成上述实验后,又深一步进行“氧化铜用量与一定质量氯酸钾
制取氧气反应速率关系”的探究,下表是他们的有关实验数据,请你回答有关问题:
氧化铜与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
(分析整理)据上表可知氧化铜用量过多,产生氧气的速率_____(填“变快”、“变慢”或“不变”),氧化铜与氯酸钾的质量比为_____时,反应速率最快。
(结论2)在化学反应中催化剂的用量_____(填“是”或“不是”)越多越好。
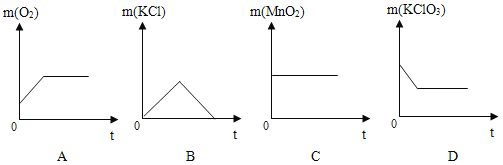
(能力提升)在一定质量的氯酸钾中加入少量的氧化铜并加热到不再产生气体为止,下图中能正确表示反应前后各物质的质量变化(m)与时间(t)关系的是_____。
(提出问题)②双氧水分解速度还和什么因素有关。
(设计并完成实验)
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
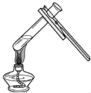
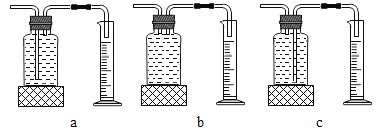
本实验中,测量O2体积的装置是_____(填编号)。
(结论3)在相同条件下,双氧水的_____,双氧水分解得越快。
【题目】如图所示,将少量液体X加入烧瓶中,观察到气球逐渐膨胀。下表中液体X和固体Y的组合,符合题意的是( )
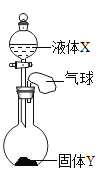
① | ② | ③ | ④ | |
| 过氧化氢溶液 | 水 | 水 | 水 |
| 二氧化锰 | 氯化钠 | 氢氧化钠 | 硝酸铵 |
A. ①②B. ①③C. ①③④D. ②③④