题目内容
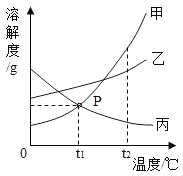
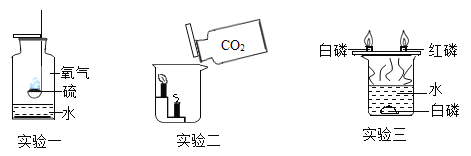
【题目】根据如图的溶解度曲线,下列说法中不正确的是
A.t2°C时,甲、乙的饱和溶液中溶质质量分数相等
B.t2°C时,甲和乙的溶解度相同
C.将t3°C时甲、乙两物质的饱和溶液降温到t1°C时甲比乙析出的晶体多
D.当甲中混有少量乙时,可采用降温结晶的方法提纯甲
【答案】C
【解析】
A、由图可知,t2℃时甲和乙的溶解度相等,所以饱和溶液中溶质的质量分数相等,故正确;
B、由图可知,t2℃时甲和乙的溶解度相等,故正确;
C、将t3℃时甲、乙两物质的饱和溶液降温到t1℃,因为不知道溶液质量的大小,故无法比较析出晶体的大小,故错误;
D、甲的溶解度随温度升高而增大且变化较大,乙的溶解度受温度影响不大,所以当甲中混有少量乙时,可用降温结晶的方法提纯甲,故正确。
故选C。

 优等生题库系列答案
优等生题库系列答案【题目】工业上用电解饱和食盐水的方法制备烧碱(NaOH)、氯气(Cl2)和氢气,并以它们为原料生产一系列化工产品,称为氯碱工业,某化学兴趣小组同学在实验室进行如下探究:
探究一:验证电解饱和食盐水的产物
(查阅资料)(1)氯气在通常情况下呈黄绿色、是一种有强烈刺激性气味的有毒气体;(2)氯气能与碱溶液发生反应,能使湿润的淀粉碘化钾试纸变蓝。
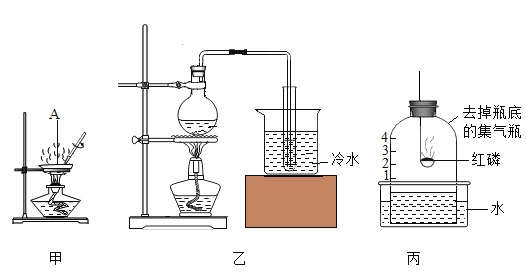
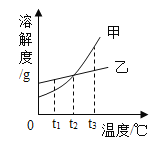
(实验验证)按图甲所示装置进行实验探究
接通电源一段时间后,观察到X、Y电极周围均有气泡产生,溶液由无色变为红色。用小试管在a端收集气体,移近酒精灯火焰,松开拇指,发出轻微的爆鸣声。将湿润的淀粉碘化钾试纸放在b端,试纸变蓝。
(实验分析)
(1)a端收集到的气体是_____。
(2)电解饱和食盐水的化学方程式为_____。
(3)b端后连接乙装置,乙装置中氢氧化钠溶液的作用是_____。
(拓展延伸)上述电解饱和食盐水实验中,电解产物之间能发生化学反应。为避免产物混合发生反应,工业上常用离子交换膜法进行生产制备,将得到的溶液蒸发结晶获得烧碱。
探究二:工业上生产的烧碱中含有哪些杂质?
(猜想假设)
猜想一:NaCl
猜想二:Na2CO3
猜想三:NaCl和Na2CO3
工业上生产的烧碱中可能含有Na2CO3,作出此猜想的依据是_____。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取少量烧碱样品于试管中,加适量水溶解,加入过量的稀硝酸,再滴加少量硝酸银溶液 | _____ | 猜想三正确 |
(反思评价)
(1)小乐同学认为上述实验中可用稀盐酸代替稀硝酸,小娟不同意,小娟的理由是_____,
(2)除去烧碱溶液中少量的碳酸钠,可选用的药品是_____ (填标号)。
A CuCl2溶液
B Ba(NO3)2溶液
C Ba(OH)2溶液
D KOH溶液
【题目】(1)为测定空气中氧气含量,某小组同学选用40mL的试管作反应容器和量程体积足够大且润滑很好的针筒注射器(如图) ,将足量白磷放入试管后,用橡皮塞塞紧试管,并夹紧弹簧夹。用酒精灯加热白磷,燃烧结束后,待试管冷却后松开弹簧夹,观察现象。
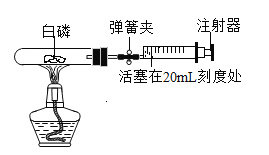
①开始实验前,该小组同学打开弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处。该操作的主要目的是_______。
②实验后,可以观察到针筒活塞会从原来的20mL刻度处慢慢向左移到约__处。
a 4mL刻度
b 8mL刻度
c 12mL刻度
d 16mL刻度
③下列实验操作,对实验结果有影响的是______。
a 装置漏气
b 白磷过量
c 燃烧结束后,立即松开弹簧夹,观察现象
(2)小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小婧查阅资料, 记录了下列几种物质的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg( NO3)2 | Mg( OH)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 |
[初步分析]其他同学认为不可能生成上表中的_____,理由是______。
[提出猜想]分析资料,小婧认为淡黄色固体可能是由镁与空气中的___反应生成的。
[实验探究]小婧设计实验证实了自己猜想。
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:______;___。
[反思与评价]①空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释____。
②通过上述实验,你对燃烧有什么新的认识?_____。