��Ŀ����
����Ŀ����ҵ���õ�ⱥ��ʳ��ˮ�ķ����Ʊ��ռNaOH����������Cl2������������������Ϊԭ������һϵ�л�����Ʒ����Ϊ�ȼҵ��ij��ѧ��ȤС��ͬѧ��ʵ���ҽ�������̽����
̽��һ����֤��ⱥ��ʳ��ˮ�IJ���
���������ϣ���1��������ͨ������³ʻ���ɫ����һ����ǿ�Ҵ̼�����ζ���ж����壻��2�������������Һ������Ӧ����ʹʪ��ĵ��۵⻯����ֽ������
��ʵ����֤����ͼ����ʾװ�ý���ʵ��̽��
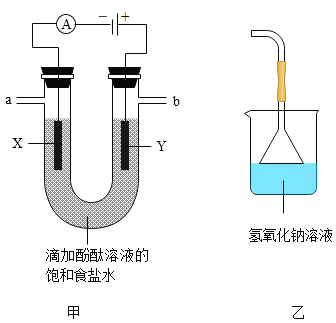
��ͨ��Դһ��ʱ��۲쵽X��Y�缫��Χ�������ݲ�������Һ����ɫ��Ϊ��ɫ����С�Թ���a���ռ����壬�ƽ��ƾ��ƻ��棬�ɿ�Ĵָ���������ı���������ʪ��ĵ��۵⻯����ֽ����b�ˣ���ֽ������
��ʵ�������
��1��a���ռ�����������_____��
��2����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ_____��
��3��b�˺�������װ�ã���װ��������������Һ��������_____��
����չ���죩������ⱥ��ʳ��ˮʵ���У�������֮���ܷ�����ѧ��Ӧ��Ϊ��������Ϸ�����Ӧ����ҵ�ϳ������ӽ���Ĥ�����������Ʊ������õ�����Һ�����ᾧ����ռ
̽��������ҵ���������ռ��к�����Щ���ʣ�
��������裩
����һ��NaCl
�������Na2CO3
��������NaCl��Na2CO3
��ҵ���������ռ��п��ܺ���Na2CO3�������˲����������_____��
��ʵ��̽����
ʵ����� | ʵ������ | ʵ����� |
ȡ�����ռ���Ʒ���Թ��У�������ˮ�ܽ⣬���������ϡ���ᣬ�ٵμ�������������Һ | _____ | ��������ȷ |
����˼���ۣ�
��1��С��ͬѧ��Ϊ����ʵ���п���ϡ�������ϡ���ᣬС�겻ͬ�⣬С���������_____��
��2����ȥ�ռ���Һ��������̼���ƣ���ѡ�õ�ҩƷ��_____ �����ţ���
A CuCl2��Һ
B Ba(NO3)2��Һ
C Ba(OH)2��Һ
D KOH��Һ
���𰸡����� 2NaCl+2H2O![]() 2NaOH+H2��+Cl2�� �������� ���������ܺͿ����еĶ�����̼��Ӧ����̼���ƺ�ˮ �Ȳ������ݺ������ɫ���� ϡ�����к��������ӣ�Ӱ����Ȼ��Ƶļ��� C
2NaOH+H2��+Cl2�� �������� ���������ܺͿ����еĶ�����̼��Ӧ����̼���ƺ�ˮ �Ȳ������ݺ������ɫ���� ϡ�����к��������ӣ�Ӱ����Ȼ��Ƶļ��� C
��������
̽��һ������ȼ������ˮ����ⱥ��ʳ��ˮ�����������ơ�����������������������Һ�ܹ�����������
̽�������������ƺͶ�����̼��Ӧ����̼���ƺ�ˮ��ϡ�����̼���Ʒ�Ӧ���������ơ�ˮ�Ͷ�����̼���Ȼ��ƺ���������Ӧ���ɰ�ɫ�����Ȼ����������ƣ�̼���ƺ�����������Ӧ����̼�ᱵ�������������ơ�
̽��һ����1��a���ռ����������ƽ��ƾ��ƻ��棬�ɿ�Ĵָ���������ı�����������Ϊ����ȼ������ˮ��˵�����������������������
��2����ʪ��ĵ��۵⻯����ֽ����b�ˣ���ֽ������˵��b�˲�������������������ⱥ��ʳ��ˮ�����������ơ���������������Ӧ�Ļ�ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2�������2NaCl+2H2O
2NaOH+H2��+Cl2�������2NaCl+2H2O![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��3���������Ժ��������Ʒ�Ӧ������b�˺�������װ�ã���װ��������������Һ�������������������������������
̽���������������ܺͿ����еĶ�����̼��Ӧ����̼���ƺ�ˮ�����Թ�ҵ�����ɵ��ռ��п��ܺ���Na2CO3��������������ܺͿ����еĶ�����̼��Ӧ����̼���ƺ�ˮ��
[ʵ��̽��]
��������ȷ˵���ռ��к���NaCl��Na2CO3��ϡ�����̼���Ʒ�Ӧ�����˶�����̼���Ȼ��ƺ���������Ӧ�����˰�ɫ�����Ȼ����������������Ȳ������ݺ������ɫ����������Ȳ������ݺ������ɫ������
[��˼����]
��1��ϡ�����к��������ӣ�����ϡ�����ʹ�ռ���û���Ȼ���Ҳ�����ɰ�ɫ������������������Ȼ��ơ����ϡ�����к��������ӣ�Ӱ����Ȼ��Ƶļ��顣
��2����ȥ�ռ���Һ��������̼���ƣ���ѡ�õ�ҩƷ������������Һ������Ϊ����������̼���Ʒ�Ӧ����̼�ᱵ�������������ƣ����˵õ�����������Һ��CuCl2���NaOH��ȥ��Ba(NO3)2�����������ʣ�KOH�������ʲ�������Ӧ��
��ѡC��

����Ŀ��ijУ��ѧ��ȤС����̽�� CO2 �� NaOH ��Һ��Ӧ���������ɡ�
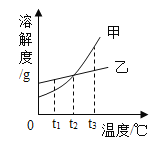
���������ϣ�20��ʱ������������ˮ�е��ܽ�ȣ�S����
���� | Na2CO3 | NaHCO3 | Ca��OH��2 | Ba��OH��2 | NaOH |
S/g | 21.5 | 9.6 | 0.165 | 3.89 | 109 |
��ʵ��̽����
ʵ��һ��ȡ��ֻ���� CO2 �Ŀ�Ȫˮƿ���ֱ����50mL ��ˮ�͵������ NaOH ��Һ������š��ƿ�ǣ� ʵ����ͼ�������ƿ�ӱ��̶� A______B���� ��������=������������
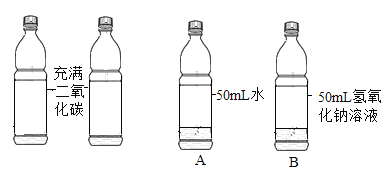
ʵ�������֤ B ƿ�з�Ӧ������ Na2CO3��ȡ���� B ƿ�е���Һ���μӹ��� BaCl2 ����Һ���а�ɫ�������ɣ����á�
��1���÷�Ӧ�Ļ�ѧ����ʽΪ______��
��2��ʵ���в��˽� BaCl2 ��Һ���� CaCl2 ��Һ��ԭ����______��
ʵ������ȡ����ʵ����е��ϲ���Һ�����뼸�η�̪��
��3����Һ���ɫ��˵����Һ�л��� NaOH��
��4��ʵ����б����������� BaCl2 ��Һ��������______��
��ʵ��̽����
���������ϣ�
��1����ʵ�������£�NaOH ��Һ��Na2CO3 ��Һ��NaHCO3 ��Һ�� pH �ֱ�ԼΪ 14.0��12.0�� 8.5��
��2���� CO2 ͨ�������ij���ʯ��ˮ�У���Һ����ǣ�����ͨ CO2 ���壬��������ʧ�� ����ʧ�����з����ķ�ӦΪ��CaCO3 + H2O + CO2 =Ca��HCO3��2
��������룩���� CO2 �� NaOH ��Һ��Ӧ��������л����ܺ���______���ѧʽ����
������ʵ�飩С������ʦ�İ������������ִ��������������ʵ�顣���£�Լ 20�棩�£� �� 8gNaOH ���� 190g ˮ�У�Ȼ�������г���ͨ�������̼���壬ͬʱ�����ִ������ⶨ��Һ�� pH �仯������������ͼ 2 ��ʾ��
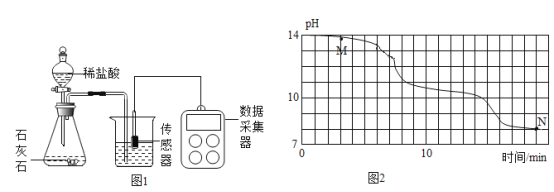
���ó����ۣ�
��1��ʵ���У�������Һ©����������������©������ԭ����______��
��2���������Ϻ�ͼ���жϣ�M������ӦΪ______���ѧʽ����
����˼������
��1��������ظ�ʵ�飬����ʵ��������һ�¡�ʵ������з��� 18min ����Һ�� pH �������ٱ仯�����ʱ�ձ���______������������������������������ԭ����______��
��2���� pH ���ٱ仯��ȡ������Һ�������еμӼ���ϡ���ᣬ�����������ݣ��÷�Ӧ�Ļ�ѧ����ʽΪ_______��