题目内容
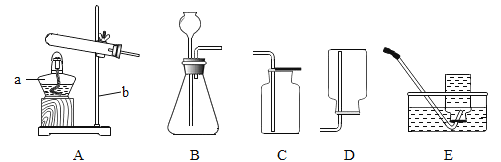
【题目】结合如图所示实验,回答下列问题:
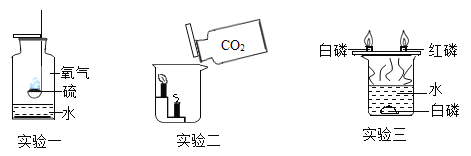
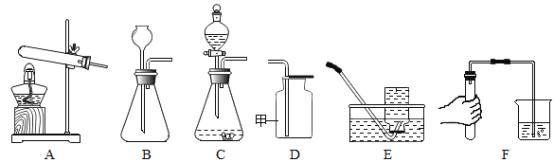
(1)在实验一中,写出发生反应的化学方程式为______;
(2)由实验二可知,![]() 具有的化学性质是______;
具有的化学性质是______;
(3)在实验三中,铜片上的白磷燃烧,水中的白磷不燃烧,由此能够得出燃烧的条件之一是______。
【答案】S+O2![]() SO2 不能燃烧,也不支持燃烧 充足的空气(氧气)
SO2 不能燃烧,也不支持燃烧 充足的空气(氧气)
【解析】
(1)硫在氧气中燃烧生成二氧化硫,反应的化学方程式为S+O2![]() SO2;
SO2;
(2)实验二中,观察到烧杯中的蜡烛由低到高依次熄灭,这一现象说明二氧化碳的密度比空气大(物理性质),不燃烧、也不支持燃烧(化学性质);
(3)在实验三中,温度达到了白磷的着火点,但是铜片上的白磷燃烧水中白磷不燃烧,由此能够得出燃烧的条件之一是与氧气充分接触。

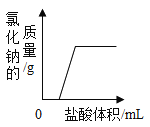
【题目】小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈中性,还可能呈酸性。
[实验验证]
实验操作 | 实验现象 | 结论 |
用试管取该溶液1 -2 mL,滴入1~2滴无色酚酞试液,振荡 | 无色酚酞试液变____ | 溶液呈碱性 |
无色酚酞试液不变色 | 溶液呈____ |
[分析与思考]
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是____ ( 填写微粒符号) ,为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入_____溶液,直到不再产生沉淀为止。然后过滤。把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为___
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到_____,则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为__;若无明显现象,则呈中性。