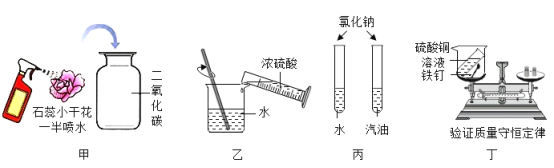
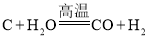题目内容
【题目】实验室使用块状石灰石(杂质不溶于水且不和水反应)和稀盐酸制取CO2,当观察不到有气泡产生,固体仍有剩余时,通常认为反应结束,剩余液呈中性,某兴趣小组对此进行了以下探究:
(实验操作)
(1)向试管中加入5粒石灰石,倾倒约试管容积1/3的稀盐酸(1:1);观察不到气泡后,仍有固体剩余;将试管静置。
(2)取上层清液,用pH试纸测得溶液pH=2,说明溶液显酸性
(提出问题Ⅰ)
反应后剩余溶液中有哪些物质?其中能使溶液pH=2的有哪些?
(实验探究Ⅰ)
(1)甲同学通过实验排除了CaCl2的可能性,简述其实验方案_____。
(2)乙同学将CO2通入蒸馏水中至饱和,测得pH>5。
(3)综合甲、乙两同学实验得出的结论是:剩余液中还含有_____。
(提出问题Ⅱ)
试管中剩余固体是否仍含有CaCO3?
(实验探究Ⅱ)
小组同学向试管中继续加入稀盐酸(1:1),又有大量气泡产生。
(1)由此得出的结论是剩余固体中含有CaCO3;发生反应的化学方程式是_____。
(2)比较稀盐酸加入前后的实验现象,解释“又有大量气泡产生”的原因是_____。
(拓展延伸)
(1)反应剩余液放置一段时间后,溶液pH增大,其主要原因是_____。
(2)假如用100g 14.6%的稀盐酸和足量的石灰石反应,看不到气泡产生时,停止收集气体,收集到的CO2质量_____(填“大于”、“小于”或“等于”)8.8g。
【答案】取CaCl2固体溶于水,测其溶液的pH 盐酸 ![]() 盐酸浓度增大,又与碳酸钙反应 碳酸钙与盐酸继续反应或剩余碳酸钙又消耗盐酸,使其浓度减小(合理答案均可) 小于
盐酸浓度增大,又与碳酸钙反应 碳酸钙与盐酸继续反应或剩余碳酸钙又消耗盐酸,使其浓度减小(合理答案均可) 小于
【解析】
本题通过分析反应剩余物质成分,可以得出反应物浓度对反应的影响。
(1)测定CaCl2溶液的的酸碱度,实验方案为取CaCl2固体溶于水,测其溶液的pH,且=7。
(2)综合甲、乙两同学实验得出的结论是氯化钙溶液和二氧化碳水溶液的pH不可能等于2,所以剩余液中还含有盐酸。
(3)再向剩余固体滴加稀盐酸,又有大量气泡产生,发生反应的化学方程式是![]() 。
。
(4)比较稀盐酸加入前后的实验现象,解释“又有大量气泡产生”的原因是盐酸浓度增大,又与碳酸钙反应。
(5)反应剩余液放置一段时间后,碳酸钙与盐酸继续反应,盐酸越来越少,浓度减小,溶液pH增大。
(6)解:设100g 14.6%的稀盐酸完全反应,生成二氧化碳的质量为X。

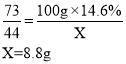
当稀盐酸和足量的石灰石反应时,盐酸的浓度降低至一定浓度时反应会停止,但盐酸没有完全参与反应,收集到的气体小于理论值,所以看不到气泡产生时,停止收集气体,收集到的CO2质量小于8.8g。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】小强同学前往当地的石灰石矿区进行调查,他取回了若干块石灰石样品,对样品中碳酸钙的质量分数进行检测,采用如下方法:取8g这种石灰石样品,把40g稀盐酸分4次加入,测量过程所得数据如下表所示(已知石灰石样品中含的杂质不溶于水,也不与稀盐酸反应)。
序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
第1次 | 10 | 5.5 |
第2次 | 10 | M |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
请计算:
(1)样品中碳酸钙的质量分数为________________________________;
(2)表中m的数值应为______________________________;
(3)所加稀盐酸的溶质质量分数________________。