题目内容
【题目】如图是某实验小组将等质量、等质量分数的氢氧化钡溶液和稀盐酸充分混合过程中利用数字传感器测定的溶液pH曲线。
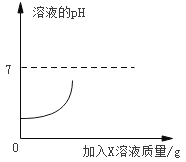
(1)写出上述反应的化学方程式_____。
(2)根据图示推测X的化学式_____。
(3)上述反应完全后,写出所得溶液与稀硫酸、硝酸银、硫酸铜、铜、铁五种物质中不能反应的物质名称并简述原因_____。
【答案】Ba(OH)2+2HCl=BaCl2+2H2O Ba(OH)2 铜;等质量、等质量分数的氢氧化钡溶液和稀盐酸充分混合,完全反应后溶液的pH<7,即Ba(OH)2完全反应,盐酸过量,反应后溶液的溶质为BaCl2和HCl,所给物质中只有铜与BaCl2、HCl不发生化学反应
【解析】
(1)氢氧化钡与稀盐酸反应,生成氯化钡和水,故填写:Ba(OH)2+2HCl=BaCl2+2H2O;
(2)由图可知,图中起点pH<7,说明反应前溶液为酸性,即反应前容器中盛有稀盐酸,将氢氧化钡滴入稀盐酸中,因此,X溶液为氢氧化钡,故填写:Ba(OH)2;
(3)由图可知,等质量、等质量分数的氢氧化钡溶液和稀盐酸充分混合,完全反应后溶液的pH<7,即Ba(OH)2完全反应,盐酸过量,反应后溶液的溶质为BaCl2和HCl,稀硫酸、硝酸银、硫酸铜都与氯化钡反应,氯化氢与硝酸银、铁反应,只有铜与BaCl2、HCl不发生化学反应,故填写:铜;等质量、等质量分数的氢氧化钡溶液和稀盐酸充分混合,完全反应后溶液的pH<7,即Ba(OH)2完全反应,盐酸过量,反应后溶液的溶质为BaCl2和HCl,所给物质中只有铜与BaCl2、HCl不发生化学反应。

练习册系列答案
相关题目