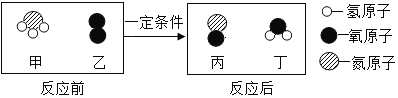
��Ŀ����
����Ŀ��Ϊ̽��˫��ˮŨ�ȡ��¶ȡ��Ƿ��д��������ض�˫��ˮ�ֽ�����������ʵ�Ӱ��ij�о�С������±��е�ʵ�飬����¼��������ݡ�
ʵ����� | ˫��ˮ��Ũ�� | ˫��ˮ�����mL�� | �¶ȣ��棩 | MnO2������g�� | ����125mL��������ʱ�䣨s�� |
�� | 5% | 20 | 20 | 0.2 | 11 |
�� | 30% | 20 | 20 | 0.2 | 2 |
�� | 30% | 20 | 40 | 0 | 148 |
�� | 30% | 20 | 90 | 0 | 82 |
�� | ���� |
��1��ͨ��ʵ���������Աȣ����Եó�˫��ˮŨ�ȶԷ�Ӧ����Ӱ��Ľ�����_____��
��2��ͨ��ʵ��_____����ʵ����ţ���ͬ����_____�Աȿ�֪����Ӧ���������¶��йء�
��3������ʵ��������ʵ���һ����������_____����Ӧ�Ļ�ѧ����ʽΪ_____��
��
���𰸡�˫��ˮ��Ũ��Խ��Ӧ����Խ�� �� �� �� 2H2O2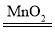 2H2O+O2�� ���� ˫��ˮ��Ũ��Ϊ5%��˫��ˮ���Ϊ20mL���¶�Ϊ20�棻�������̵�����Ϊ0
2H2O+O2�� ���� ˫��ˮ��Ũ��Ϊ5%��˫��ˮ���Ϊ20mL���¶�Ϊ20�棻�������̵�����Ϊ0
��������
��1��ʵ���������У�����˫��ˮ��Ũ�Ȳ�ͬ���⣬�������ؾ���ͬ����ʵ�����ݿ�֪��˫��ˮ��Ũ��Խ������ͬ�����������ʱ��Խ�̣�����Ӧ����Խ�죻����ͨ��ʵ���������Աȣ����Եó�˫��ˮŨ�ȶԷ�Ӧ����Ӱ��Ľ�����˫��ˮ��Ũ��Խ��Ӧ����Խ�죻���˫��ˮ��Ũ��Խ��Ӧ����Խ�죻
��2��ʵ������ʵ�����У����¶Ȳ�ͬ���⣬����������ȫ��ͬ������̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻����� ���� ��
��3����ʵ�����ݿ�֪������ʵ��������ʵ���һ�����������������������·�Ӧ���еĿ������У����ڲ������ռ������������ڶ������̵Ĵ������·ֽ�Ϊˮ������������� ��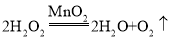 ��
��
��4���Ա�ʵ�������Ʊ���Ψһ�ԣ�ֻ������ʵ�鲻�ܵó����ڴ�����ʹ�öԷ�Ӧ����Ӱ�졣�����һ��ʵ���� ��˫��ˮ��Ũ��Ϊ5%��˫��ˮ���Ϊ20mL���¶�Ϊ20�棻�������̵�����Ϊ0����ʵ������ʵ�������жԱȼ��ɵó�������ʹ�öԷ�Ӧ����Ӱ�죻������ܣ�˫��ˮ��Ũ��Ϊ5%��˫��ˮ���Ϊ20mL���¶�Ϊ20�棻�������̵�����Ϊ0��

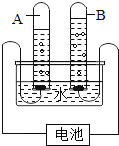
����Ŀ����ͼΪʵ������������װ��ͼ�����A��B��������ѡһ����������������𣬰�A�Ʒ֡�
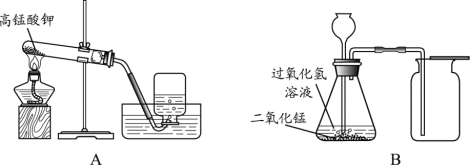
A | B |
��1��Aͼ�з�Ӧ�Ļ�ѧ����ʽΪ________�� ��2��O2������ˮ���ռ�����ԭ����________�� | ��1��Bͼ�з�Ӧ�Ļ�ѧ����ʽΪ________�� ��2��B�г���©��������Һ���ڵ�ԭ����________�� |